Revêtement en carbone dopé F Anode Nano-Si à Haute Capacité : Préparation par Fluoration Gazeuse et Performances pour le stockage du lithium
Auteur : SU Nan, QIU Jieshan, WANG Zhiyu. Dopé F Anode Nano-Si recouverte de carbone à haute capacité : préparation par fluoration gazeuse et performances pour le stockage du lithium. Journal des matériaux inorganiques, 2023, 38(8) : 947-953 DOI:10.15541/jim20230009
Résumé
Les anodes en Si recèlent un immense potentiel dans le développement du Li-ion à haute énergie piles. Mais un échec rapide dû à un énorme changement de volume lors de l'absorption du Li entrave leur candidature. Ce travail fait état d'une fluoration de gaz facile mais peu toxique moyen de produire des matériaux d'anode nano-Si recouverts de carbone dopé au F. Revêtement de Le nano-Si avec du carbone dopé au F contenant des défauts élevés peut protéger efficacement le Si d'un énorme changement de volume lors du stockage de Li tout en facilitant le transport et formation d’une interphase d’électrolyte solide (SEI) stable et riche en LiF. Cette anode présente capacités élevées de 1 540 à 580 mAh·g-1 à divers taux actuels de 0,2 à 5,0 A·g-1, tout en conservant 75% de capacité après 200 cycles. Cette méthode aborde également les problèmes de coût élevé et toxicité des techniques traditionnelles de fluoration utilisant le fluor sources telles que XeF2 et F2.
Mots clésï¼ Batterie Li-ion ; Si anode; Carbone dopé F ; fluoration gazeuse méthode
Développer un stockage d’énergie efficace et les technologies de conversion contribueront à atteindre l’objectif de « plafonnement des émissions de carbone et neutralité carbone ». Les batteries lithium-ion sont actuellement l'une des plus répandues utilisé des technologies de stockage d’énergie à haut rendement [1]. Cependant, commercial Les anodes en graphite ont une faible capacité de stockage du lithium, ce qui limite considérablement la densité énergétique des batteries lithium-ion [2]. Le silicium présente les avantages d'être faible réserves potentielles et abondantes, et sa capacité spécifique théorique (4200 mAh·g-1) est beaucoup plus élevé que celui de l'anode en graphite, il est donc considéré comme un matériau d'anode candidat pour remplacer le graphite [3]. Les matériaux en silicium atteignent stockage du lithium basé sur la réaction d'alliage réversible avec les ions lithium, mais ce processus s'accompagne d'énormes changements de volume (~ 400 %), ce qui conduit à poudrage rapide et défaillance de l'électrode, devenant un goulot d'étranglement majeur restreindre l'application pratique des anodes en silicium [3-4].
Ces dernières années, les chercheurs ont développé une variété de stratégies pour améliorer la stabilité et l’électrochimie performances des anodes en silicium. Tels que : nanométrisation [5], structurel composite avec du carbone conducteur et d'autres matériaux [6-7], etc. Améliorer le stabilité structurelle de l'anode en silicium en atténuant les contraintes mécaniques associé à l’expansion volumique du stockage du lithium au niveau microscopique échelle. Développer de nouveaux électrolytes ou additifs électrolytiques pour améliorer stabilité et efficacité coulombienne de la phase d'interface électrolyte solide (SEI) à la surface de l’anode en silicium [8]. Développer un polymère efficace liants (tels que la carboxyméthylcellulose de sodium, l'alginate de sodium, le polyacrylique polyrotaxane à base d'acide [9], etc.). Renforcer la force de liaison entre les actifs matériaux, entre matériaux actifs et réseau conducteur, et entre film d'électrode et collecteur de courant [9-10]. Parmi eux, le revêtement en carbone en est un des moyens les plus efficaces pour améliorer la stabilité structurelle des anodes en silicium et moduler les propriétés de surface et d'interface [3-4,11]. Cependant, le étroitement La couche de carbone hautement stable enrobée entrave également le transport des ions lithium et limite la pleine performance de l'anode en silicium.
De plus, le volume répété changements de l'anode en silicium pendant le processus continu de charge et de décharge provoque également la rupture et la croissance continue du film SEI, ce qui entraîne la perte continue de lithium actif et d'électrolyte à la surface de l'électrode [12]. En réponse aux problèmes ci-dessus, cette étude propose une approche efficace procédé de fluoration en phase gazeuse pour recouvrir la surface du matériau d'anode en silicium avec une couche de carbone amorphe hautement défectueuse riche en éléments fluorés pour améliorer sa structure et la stabilité de son interface. Par rapport au traditionnel technologie de fluoration qui utilise des sources de fluor coûteuses et hautement toxiques comme XeF2 ou F2 [13], cette stratégie est plus simple et moins toxique. Le Une couche de carbone dopé au fluor recouvrant la surface des matériaux nano-silicium peut tamponne efficacement l'expansion volumique des anodes en silicium intégrées au lithium tout en améliorant les capacités de transport des ions lithium. Et un SEI très stable un film riche en fluorure inorganique est construit in situ pour atteindre l'objectif de améliorer la stabilité du cycle de l'anode en silicium.
1 Méthode expérimentale
1.1 Préparation du matériel
Préparation de revêtements en carbone nano-silicium (Si@C) :0,3 g de nanosilice commerciale la poudre (taille des particules 20 ~ 100 nm, réactif d'Aladdin) a été ultrasonique dispersé dans 28 ml d'un solvant mélangé d'eau déminéralisée et d'éthanol (volume rapport 5:2). Après avoir ajouté 0,4 mL de 3-aminopropyltriéthoxysilane, remuer pendant 2 h pour former une dispersion uniforme A. Dissoudre 0,115 g de 4,4-dihydroxydiphényle sulfure et 0,1 g de 3-aminophénol dans 28 ml d'un solvant mixte déionisé eau et éthanol (rapport volumique 5:2) pour former une solution homogène B. Mélanger dispersion A et solution B uniformément, ajouter 0,1 mL d'eau ammoniaquée, remuer pendant 30 min, puis ajoutez 0,14 mL de solution de formaldéhyde (37 % ~ 40 %) et réagissez avec une constante sous agitation à 30°C pendant 12 h. Après la réaction, le revêtement en résine phénolique La nanosilice (Si@AF) a été obtenue par centrifugation et lavage avec de l'éthanol et eau déionisée en alternance trois fois. Il a été calciné dans du gaz argon à 800°C pendant 3 h pour obtenir du nano-silicium recouvert de carbone (Si@C).
Préparation de dopé au fluor Nano-silicium recouvert de carbone (Si@C-F) : 100 mg Si@C et 200 mg le fluorure de polyvinylidène (PVDF) ont été placés dans un four tubulaire protégé par de l'argon. La nacelle en quartz contenant du PVDF est située en amont du flux d'air, et le Une nacelle en quartz contenant du Si@C est située en aval du flux d'air. Il est rôti à 600 ° C pendant 3 h pour obtenir du nano-silicium recouvert de carbone dopé au fluor (Si@C-F).
1.2 Assemblage de la batterie et tests de performances électrochimiques
1.2.1 Ensemble batterie
Assembler la pile bouton CR2016 pour les tests. Mélanger la matière active, le noir de carbone conducteur et liant carboxyméthylcellulose sodique uniformément dans un rapport massique de 7:2:1. Désionisé de l'eau a été ajoutée comme solvant et dispersant, et la suspension obtenue a été uniformément enduit sur la feuille de cuivre comme électrode de travail. La matière active la charge était de 0,8 à 1,0 mg·cm-2. Des feuilles de lithium métallique ont été utilisées comme compteur électrodes et électrodes de référence. L'électrolyte est une solution DOL/DME dissous dans 1,0 mol/L de LiTFSI (bistrifluorométhanesulfonate imide de lithium) et 2,0 % LiNO3 (DOL est le 1, 3-dioxolane, le DME est l'éther diméthylique de l'éthylène glycol, le volume rapport 1:1). Assembler la cellule dans une boîte à gants remplie d'argon (teneur en eau < 0,1 μL/L, teneur en oxygène < 0,1 μL/L).
1.2.2 Test de performances de la batterie
Utiliser l'électrochimique IVIUM Vertex.C.EIS poste de travail pour analyser le mécanisme de réaction et la cinétique de réaction du batterie en utilisant la méthode de voltammétrie cyclique (CV). La plage de tension est de 0,01 à 1,5 V, et le taux de balayage est de 0,05 ~ 0,5 mV·s- 1. Impédance électrochimique La spectroscopie (EIS) a été utilisée pour analyser la dynamique des électrodes. La fréquence des tests la plage était de 100 kHz à 10 MHz et l'amplitude de la tension perturbatrice était de 5,0 mV. Le testeur de batterie Land CT2001A a été utilisé pour étudier les performances de stockage du lithium en utilisant la méthode de charge et de décharge à courant constant. La fenêtre de tension était 0,01~1,5 V (vs. Li/Li+), et la densité de courant était de 0,2~5,0 A·g-1.
2 Résultats et discussion
2.1 Analyse de l'aspect, de la structure et de la composition des matériaux
Le processus de préparation de Les matériaux nano-silicium recouverts de carbone dopé au fluor sont illustrés à la figure 1. Tout d’abord, des nanoparticules de silicium recouvertes de polymère (Si@AF) sont préparées à base de réaction de polymérisation par condensation phénol-aldéhyde et converti en nanoparticules de nano-silicium (Si@C) enrobées de carbone amorphe à haute température. Alors le fluorure de polyvinylidène est utilisé comme source de fluor et le fluor est dopé dans la couche de carbone à l'extérieur des nanoparticules de silicium via la phase gazeuse méthode de fluoration à haute température. La figure 2 (a) montre les modèles XRD de Matériaux Si@C et Si@C-F. Pics de diffraction situés à 2θ=28°, 47°, 56°, 69° et 76°. Ils correspondent aux cristaux (111), (220), (311), (400) et (331). plans de silicium monocristallin (JCPDS 77-2108) respectivement. Le large pic situé à 2θ=25°~26° est attribué à la structure carbonée ordonnée à courte portée formée par la carbonisation du produit de polymérisation par condensation phénolique. Le couche de revêtement en carbone à haute conductivité et excellente flexibilité structurelle peut atténuer efficacement l'échec de la pulvérisation des matériaux en silicium pendant Le processus de charge et de décharge et améliorer la conductivité de l'électrode. La figure 2 (b) est le spectre Raman des matériaux Si@C et Si@C-F, avec des valeurs évidentes pics d'absorption apparaissant à 515, 947, 1350 et 1594 cm-1. Parmi eux, le les pics d'absorption à 515 et 947 cm-1 sont les pics caractéristiques de silicium cristallin, dérivé du photophonon du premier ordre diffusion et diffusion transversale de photophonons du deuxième ordre du silicium respectivement [14]. Les pics d'absorption à 1350 et 1594 cm-1 correspondent à la configuration du carbone aromatique étirant la vibration (mode G) et le désordre structure carbonée défectueuse (mode D), respectivement. D'une manière générale, le Le rapport d'intensité du mode D et du mode G (ID/IG) peut être utilisé pour mesurer le degré des défauts et désordres des matériaux carbonés [15]. Comparé au matériau Si@C (ID/IG=0,99), l'ID/IG du matériau Si@C-F passe à 1,08. Cela montre que le le processus de fluoration peut augmenter les défauts de la couche de revêtement en carbone, ce qui est bénéfique pour enrober étroitement le nano-silicium tout en améliorant le lithium-ion capacités de transport.
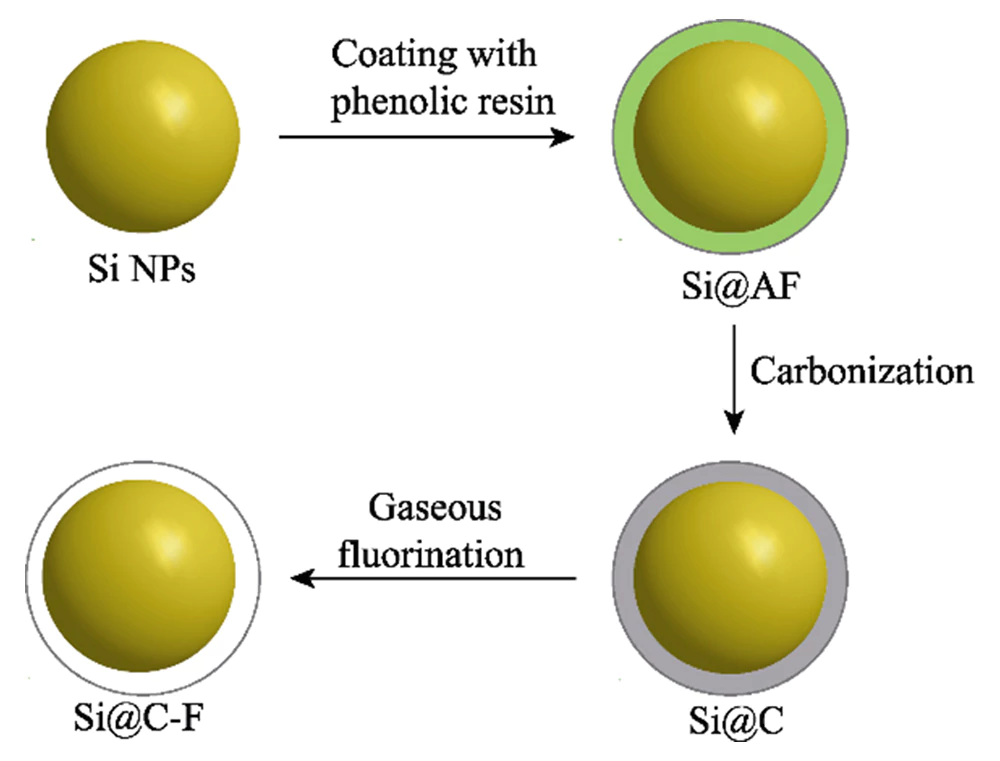
Fig. 1 Illustration schématique de la production de Si@C-F
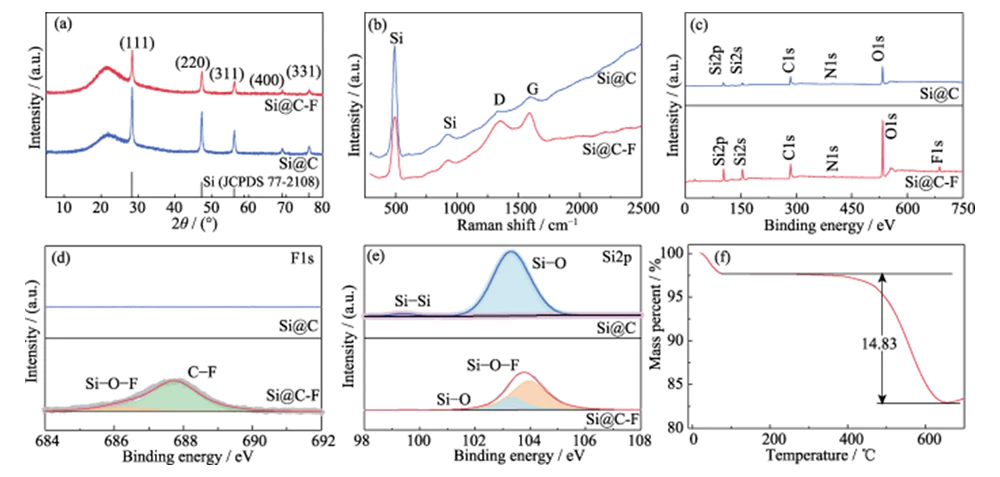
Fig. 2 (a) modèles XRD, (b) spectres Raman, (c) XPS balayage d'enquête, (d) F1 haute résolution et (e) spectres Si2p XPS de Si@C et Si@C-F, (f) courbe TGA de Si@C-F
Le spectre complet XPS montre que le Le matériau Si@C contient des éléments O, N, C et Si (Figure 2 (c)). L'atomique fraction d'élément F dans le matériau Si@C-F obtenu après fluoration le traitement est d'environ 1,8%. Dans le spectre F1s XPS haute résolution (Figure 2 (d)), les deux pics caractéristiques à l'énergie de liaison de 686,3 et 687,8 eV correspondent respectivement à C-F et Si-O-F, et C-F est le dominant un. Cela montre que le traitement de fluoration a introduit avec succès le fluor élément dans la couche de carbone amorphe recouverte sur la surface du nano-silicium. Le Les spectres Si2p haute résolution (Figure 2 (e)) et F1s XPS prouvent que les atomes de Si interagir chimiquement avec l'élément F dans la couche de carbone en formant Si-O-F liaisons, ce qui est bénéfique pour le revêtement serré de la couche de carbone sur le surface en silicium. L'analyse thermogravimétrique (ATG) montre que la fraction massique de Si dans le matériau Si@C-F est d'environ 85,17 % (Figure 2(f)).
L'analyse SEM montre que le Si@C-F le matériau est composé de nanoparticules d’une taille <100 nm (Figure 3 (a ~ c)). Après carbonisation à haute température et traitement de fluoration en phase gazeuse, le matériau carboné est toujours uniformément recouvert sur la surface des nanoparticules de silicium.
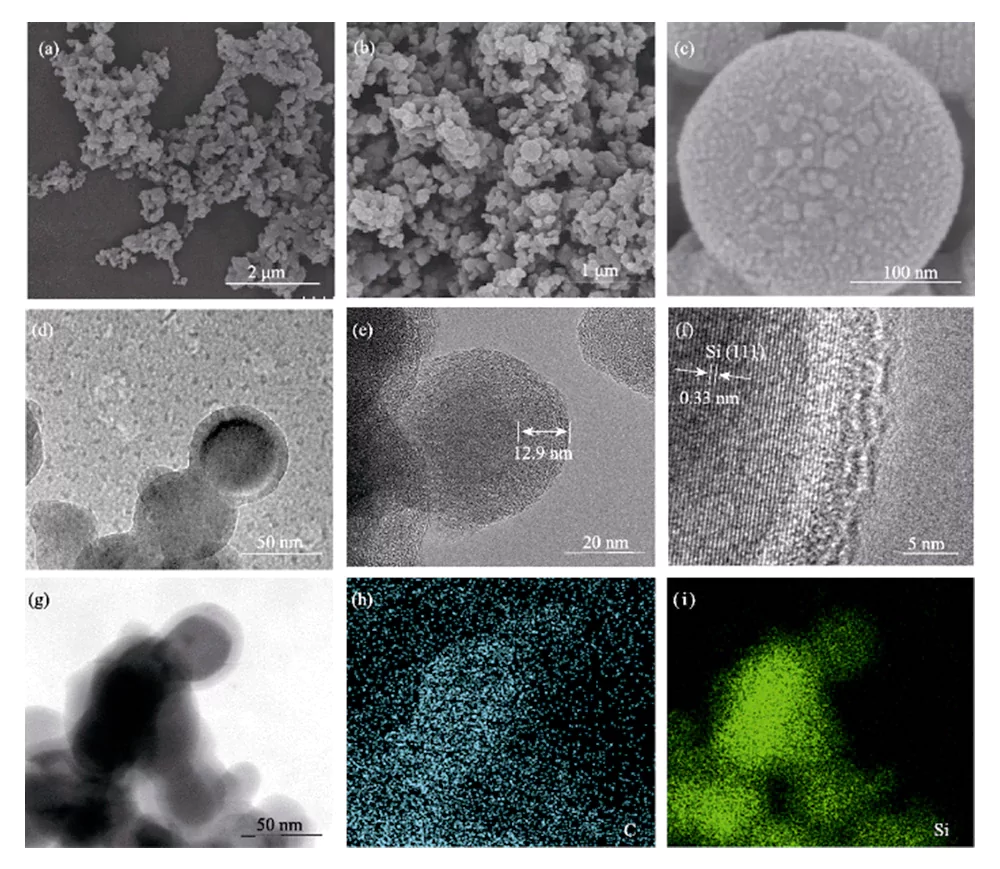
Fig. 3 (a-c) images SEM, (d-f) images TEM et (g-i) cartographie élémentaire de Si@C-F
L'analyse TEM montre que le silicium les nanoparticules sont complètement et uniformément recouvertes d'une couche de carbone avec un épaisseur d'une dizaine de nanomètres, formant une structure noyau-coquille (Figure 3(d~e)). Les nanoparticules de silicium ont une structure monocristalline dans laquelle un espacement de réseau de 0,328 nm correspond au plan cristallin (111) de Si, et la couche de carbone dopée au fluor qui la recouvre présente une structure amorphe (Figure 3f)). Le spectre de distribution des éléments prouve que les éléments C et Si sont uniformément réparti dans Si@C-F (Figure 3(g~i)).
2.2 Propriétés électrochimiques de matériaux
La figure 4 (a, b) est la courbe CV des matériaux d'anode Si@C et Si@C-F. La vitesse de balayage est de 0,1 mV · s-1 et la plage de tension est de 0,01 à 1,5 V. Dans le premier cycle, le pic large et faible dans la plage de 0,1 à 0,4 V correspond au processus irréversible de décomposition de l'électrolyte pour former un film SEI ; le le pic de réduction à 0,01 V correspond au processus du silicium cristallin former un alliage silicium-lithium (LixSi) par réaction d'alliage. Au cours de la suite processus de charge, les deux pics d'oxydation à 0,32 et 0,49 V correspondent à la processus de désalliage de LixSi pour former du silicium amorphe [16]. Fluoration le traitement peut obtenir des effets de dopage structurel et de gravure. Un grand nombre de des défauts structurels sont introduits dans la couche de carbone amorphe recouverte du surface du matériau Si pour former un transport d'ions lithium tridimensionnel Canal, accélère le transport des ions lithium et améliore l'électrochimie réactivité du matériau Si. Par conséquent, Si@C-F présente un pic d'oxydation de délithiation à 0,49 V que l'anode Si@C sans fluor dopage. Au cours du processus de décharge ultérieur, le nouveau pic de réduction à 0,19 V correspond au processus d'insertion du lithium dans le silicium amorphe formé pendant le premier processus de charge [16-17]. À mesure que le nombre de cycles augmente, les positions du pic d'oxydation et du pic de réduction dans la courbe CV non changement plus long, indiquant que les matériaux d'anode Si@C et Si@C-F suivent une évolution similaire Mécanisme de stockage du lithium allié après la première charge et décharge. Pendant ce processus, le pic d'oxydation et le pic de réduction ont progressivement augmenté, reflétant un processus typique d'activation d'électrode.
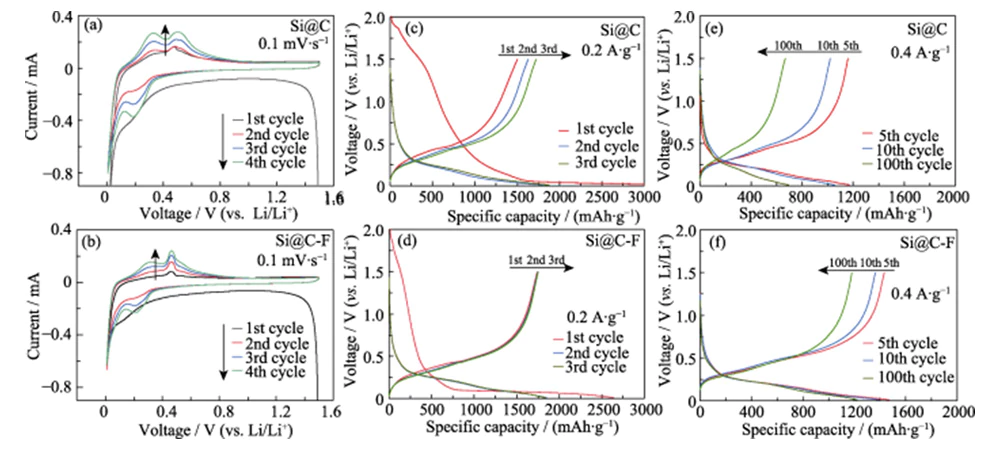
Fig. 4 (a, b) courbes CV à une vitesse de balayage de 0,1 mV·s-1 et courbes de tension de charge-décharge à (c, d) 0,2 et (e, f) 0,4 A·g-1 pour (a, c, e) Anodes Si@C et (b, d, f) Si@C-F
Dans la charge à courant constant et test de décharge, le matériau de l'anode en Si a été cyclé et activé 4 fois à une densité de courant inférieure (0,2 A·g-1), puis sa stabilité de cycle a été testée à une densité de courant de 0,4 A·g-1. La figure 4 (c, d) montre la charge galvanostatique et courbes de décharge des anodes Si@C et Si@C-F à 0,2 A·g-1, et la tension La fenêtre est de 0,01 à 1,5 V. Au cours du premier processus de décharge, les deux ont formé une longue plate-forme dans la plage de tension < 0,1 V, correspondant au processus d'insertion du lithium d'alliage de silicium cristallin. Ce processus s'accompagne souvent d'un faible rendement coulombien premier. Au cours du premier processus de charge, l'alliage silicium-lithium est délithié et transformé en silicium amorphe avec une énergie d'activation plus faible pour l'insertion du lithium [18], provoquant une augmentation du potentiel d'insertion du lithium à 0,1 ~ 0,3 V après la première charge et décharge. Par rapport à Si@C, la capacité spécifique de première décharge (2640 mAh·g-1) de l'anode Si@C-F est légèrement inférieure. Cependant, la première capacité spécifique de charge (1 739,6 mAh · g-1) est plus élevée et le premier rendement coulombique (65,9 %) est d'environ 45,8 % supérieur à celui de l'anode Si@C. La courbe charge-décharge de la région SEI de l'électrode négative Si@C-F est plus courte que celle de Si@C, indiquant qu'un film SEI plus stable se forme à la surface. En effet, la couche de carbone dopée au fluor favorise la formation d'un film SEI contenant des composants inorganiques (tels que LiF) et une plus grande stabilité à la surface de l'anode en silicium, réduisant ainsi la perte irréversible de lithium et la consommation d'électrolyte [19].
La figure 4 (e ~ f) montre les courbes de charge et de décharge de Si@C et Électrodes négatives Si@C-F à une densité de courant de 0,4 A·g-1 après activation. Après 100 cycles, l'anode Si@C-F peut encore conserver une capacité spécifique élevée de 1223 mAh·g-1, avec un taux de rétention de capacité 85 % (Figure 5(a)). Sous dans les mêmes conditions, la capacité de l'électrode négative Si@C sans le traitement de fluoration s'est rapidement dégradé pendant le processus de charge et de décharge, et le taux de rétention de capacité après 100 cycles n'était que de 62 %. Cela montre que la couche de revêtement en carbone dopé au fluor a un effet significatif sur l'amélioration la stabilité du cycle de l'anode en silicium. Commercial les anodes en nano-silicium sans revêtement de carbone échoueront après plus de 10 cycles en raison de l'énorme expansion du volume et du poudrage structurel pendant la désintercalation du lithium. Au cours de ce processus, la capacité spécifique de Les électrodes négatives Si@C-F et Si@C augmentent progressivement au cours des 10 à 20 premières cycles en raison de l’effet d’activation. À une grande densité de courant de 0,2 à 5,0 A·g-1, l'anode Si@C-F peut maintenir une capacité spécifique élevée de 1540~580 mAh·g-1, montrant une excellente rétention de capacité (Figure 5(b)). À courant élevé densité de 5,0 A·g-1, son taux de rétention de capacité est environ 78 % plus élevé que celui du Si@C. Lorsque la densité de courant est encore réduite à 0,2 A·g-1, la capacité spécifique peut être restaurée à 1450 mAh·g-1, indiquant que son la structure est très stable pendant le stockage du lithium à haut débit. Après 200 cycles de charge-décharge à une densité de courant de 0,2 A·g-1, l'anode Si@C-F peut maintenir une capacité spécifique de 75 %. Le taux de rétention de capacité du L'anode Si@C sans traitement de fluoration n'est que de 40 % (Figure 5(c)). Cette anode montre également de meilleures performances de stockage du lithium que le matériau de l'anode en silicium rapporté dans la littérature (tableau 1).
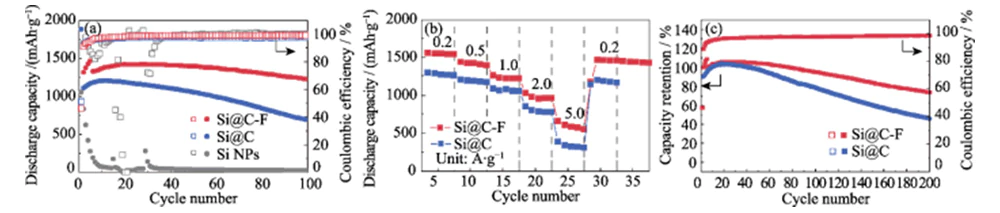
Fig. 5 (a) Stabilité du cyclage à une densité de courant de 0,4 A·g-1 avec anodes activées par 4 cycles à 0,2 A·g-1 avant le cyclage, et (b) capacité de taux à différentes densités de courant allant de 0,2 à 5,0 A·gâ1 et (c) rétention de capacité à une densité de courant de 0,2 A·g-1 pour le stockage du lithium dans l'anode Si@C et Si@C-F
Tableau 1 Comparaison de l'anode Si@C-F avec anode à base de Si rapportée en termes de performances électrochimiques
|
Matériaux |
CE initiale |
Capacité initiale/(mAh·g-1) |
Rétention de capacitérétention |
Réf. |
|
Si@C-F |
65,9% |
2640 |
85 % (100 cycles) |
Cet ouvrage |
|
nano-Si/TiN@ |
71% |
2716 |
59,4 % (110 cycles) |
[20] |
|
Si@C@RGO |
74,5% |
1474 |
48,9 % (40 cycles) |
[21] |
|
Si@FA |
65% |
1334 |
68,7 % (100 cycles) |
[22] |
|
p-Si@C |
58% |
3460 |
57,5 % (100 cycles) |
[23] |
|
Si@void@C |
- |
900 |
70 % (100 cycles) |
[24] |
|
Si/C@C |
- |
1120 |
80 % (100 cycles) |
[25] |
À courant élevé densité de 5,0 A·g-1, son taux de rétention de capacité est environ 78 % plus élevé que celui du Si@C. Lorsque la densité de courant est encore réduite à 0,2 A·g-1, la capacité spécifique peut être restaurée à 1450 mAh·g-1, indiquant que son la structure est très stable pendant le stockage du lithium à haut débit. Après 200 cycles de charge-décharge à une densité de courant de 0,2 A·g-1, l'anode Si@C-F peut maintenir une capacité spécifique de 75 %. Le taux de rétention de capacité du L'anode Si@C sans traitement de fluoration n'est que de 40 % (Figure 5(c)). Cette anode montre également de meilleures performances de stockage du lithium que le matériau de l'anode en silicium rapportés dans la littérature (tableau 1). La quantité de dopage au fluor dans le revêtement La couche de carbone a un impact significatif sur les performances de stockage du lithium du Anode Si@C-F. Lorsque la quantité de dopage au fluor est inférieure à 1,8 % de la fraction atomique, la stabilité au cyclage de l'anode Si@C-F s'améliore considérablement à mesure que le la quantité de dopage au fluor augmente (Figure 6). Cela est dû à l'effet amélioré du dopage au fluor sur les propriétés de transport des ions lithium du carbone couche de revêtement et la stabilité du film SEI à la surface du silicium matériel. Lorsque le taux de dopage du fluor est trop élevé (2,7%), le revêtu de carbone Le matériau d'anode Si conserve toujours une bonne stabilité de cycle, mais le la capacité spécifique diminue considérablement. Cela est dû à la perte de Si actif causée par la gravure d’espèces fluorées en phase gazeuse à haute température fluoration. Lorsque la quantité de dopage au fluor est de 1,8 pour cent atomique, le Si@C-F L'anode présente une stabilité de cycle optimale et une capacité spécifique élevée.
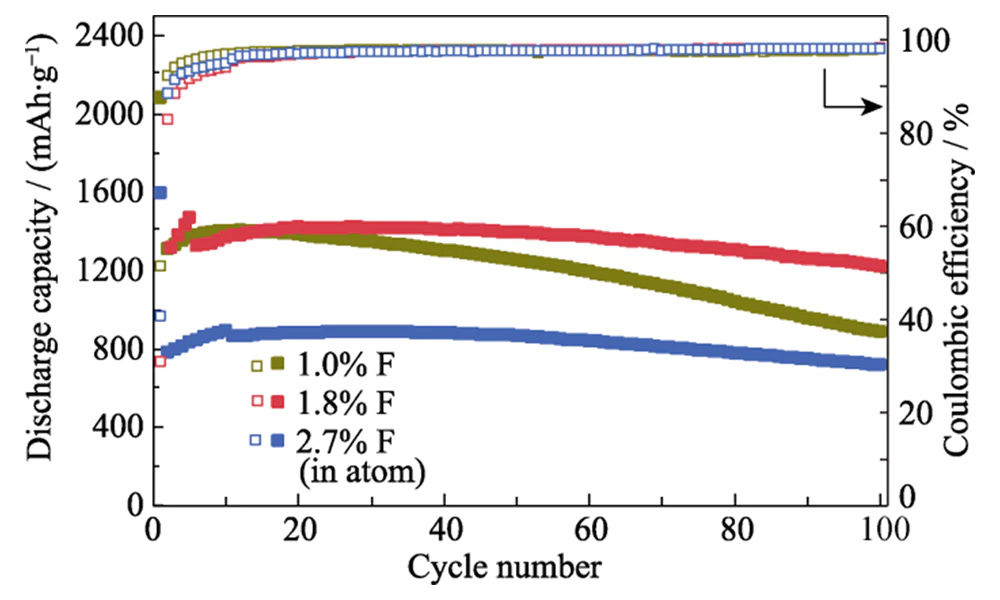
Fig. 6 Stabilité cyclique des anodes Si@C-F avec différents Rapports F à une densité de courant de 0,4 A·g-1 avec des anodes activées par 4 à 10 cycles à 0,2 A·g-1 avant le cyclisme
Les spectres EIS de Si@C et Si@C-F Les anodes sont constituées de courbes en demi-arc dans la région des moyennes et hautes fréquences et lignes droites inclinées dans la région des basses fréquences (Figure 7 (a)). Le demi-arc La courbe dans la plage des moyennes et hautes fréquences est liée au transfert de charge résistance (Rct) et la ligne droite inclinée dans la plage des basses fréquences reflète principalement l'impédance de Warburg (ZW) de la diffusion des ions lithium [26]. Avant la charge et la décharge, le Rct des électrodes négatives Si@C-F et Si@C sont similaires, mais le premier a un ZW inférieur en raison du caractère hautement défectueux couche de carbone dopée au fluor recouvrant la surface. Après charge et décharge cycles, le Rct (5,51 Ω) de l'anode Si@C-F est nettement inférieur à celui de l'anode Si@C (21,97 Ω) (Figure 7(b)), et le ZW est bien inférieur au dernier. Cela montre que le film d'interface SEI riche en fluor induit par le La couche de carbone dopée au fluor peut améliorer efficacement la charge d'interface et capacités de transport des ions lithium.
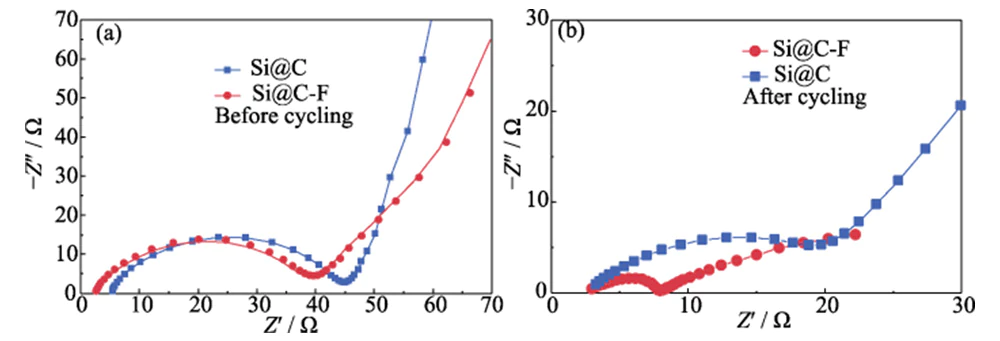
Fig. 7 Tracés de Nyquist des anodes Si@C et Si@C-F (a) avant et (b) après un cyclage à une densité de courant de 0,4 A·g-1
2.3 Caractérisation de la structure des électrodes après charge et décharge
Caractérisation SEM après charge et décharge cycles (Figure 8(a~c)) montre qu'en raison de l'expansion significative du volume Effet du silicium pendant le processus d'insertion du lithium, l'épaisseur du L'électrode Si@C a augmenté de 132,3 %. Cela entrave non seulement la transmission de Ions et électrons, augmente la résistance interne et la polarisation du électrode, mais provoque également d'énormes contraintes mécaniques, provoquant l'électrode à rupture et séparation du collecteur de courant, provoquant la performance du L'anode Si @ C se désintègre rapidement (Figure 5 (c)). En comparaison, l'électrode l'épaisseur de l'anode Si@C-F n'a augmenté que de 26,6 % après charge et cycles de décharge et maintenu une bonne stabilité structurelle de l'électrode (Figure 8(d~f)). Cela montre que la couche de carbone dopée au fluor introduite peut tamponne efficacement l'effet d'expansion volumique de l'insertion du lithium dans le silicium matériaux à l'échelle micro, améliorant ainsi la stabilité structurelle du électrode à l’échelle macro de bas en haut.
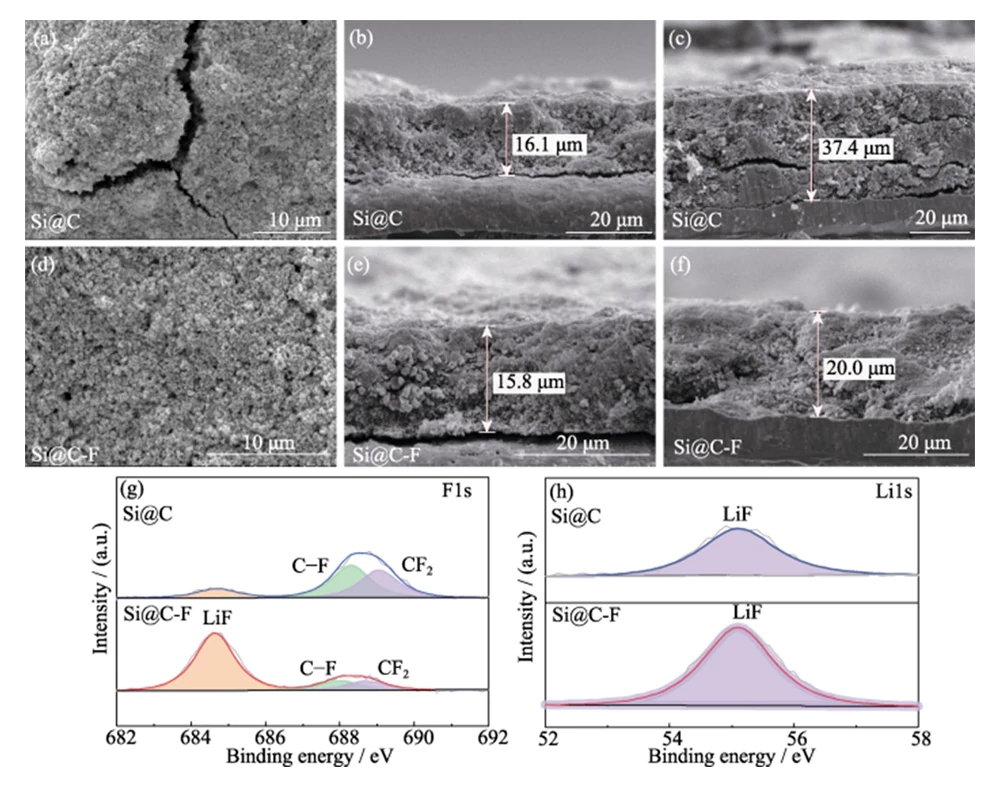
Fig. 8 Images MEB supérieures des anodes (a) Si@C et (d) Si@C-F après le vélo ; Images SEM en coupe transversale des anodes (b, c) Si@C et (e, f) Si@C-F (b, e) avant et (c, f) après le cyclisme ; Haute résolution (g) F1 et (h) Li1 Spectres XPS de SEI sur anodes Si@C et Si@C-F après cyclage
La composition du film SEI à la surface de Si@C et les électrodes négatives Si@C-F après les cycles de charge et de décharge ont été analysées par XPS (Figure 8(g~h)). Dans le spectre F1s XPS haute résolution, la liaison les pics d'énergie aux énergies de liaison de 684,8, 688,3 et 689,1 eV correspondent aux obligations LiF, CF et CF2, respectivement. En conséquence, il existe également pics caractéristiques correspondant aux espèces LiF dans les Li1 haute résolution Spectre XPS, indiquant qu'un film SEI contenant des espèces LiF est formé sur la surface de l'anode en silicium. Par rapport à l'anode Si@C, la teneur en LiF à la surface de l'anode Si@C-F est plus élevé, indiquant que le LiF dans le Le film SEI ne provient pas seulement de la décomposition des sels de lithium dans le électrolyte, mais aussi du F dans la couche de carbone dopée au fluor. Le la formation de LiF à module élevé peut augmenter efficacement la résistance structurelle du film SEI et inhibe le changement de volume de l'insertion du lithium dans le silicium matériels. Dans le même temps, la large bande interdite et les propriétés isolantes du LiF peut réduire l'épaisseur du SEI et réduire la perte initiale irréversible de lithium. L'alliage LixSi, le produit de lithiation de LiF et Si, présente une surface interfaciale élevée énergie et peut mieux s'adapter à la déformation plastique du silicium lithié anode pendant le cyclage, améliorant ainsi encore la stabilité du cyclage du électrode [19].
3 Conclusion
Dans cette étude, des produits dopés au fluor Des matériaux nano-silicium recouverts de carbone ont été préparés par un procédé simple et méthode de fluoration en phase gazeuse peu toxique. La recherche montre que le dopage au fluor (1,8% F), d'une part, augmente les défauts de la couche de revêtement en carbone sur La surface du silicium et fournit de nombreux canaux de transport d'ions lithium tout en enrobant étroitement le nano-silicium pour supprimer son expansion volumique. De l'autre D'autre part, un film SEI très stable et riche en LiF est induit à la surface du matériau nano-silicium, améliorant encore la stabilité et l'efficacité coulombienne de l'anode en silicium. Grâce à cela, la première efficacité coulombienne du Anode en nano-silicium recouverte de carbone dopée au fluor améliorée à 65,9 %. A un courant densité de 0,2~5,0 A·g-1, il présente une capacité spécifique élevée de 1540~580 mAh·g-1, et peut maintenir 75 % de la capacité initiale après 200 cycles. Ce travail fournit de nouvelles idées pour la conception et la construction d'anodes en silicium matériaux à haute capacité et haute stabilité.
Référence
[1] NIU S S, WANG Z Y, YU M L, et al.À base de MXène Électrode avec pseudocapacitance améliorée et capacité volumétrique pour la puissance- type et stockage au lithium à très longue durée de vie.ACS Nano, 2018, 12(4) : 3928.
[2] SU X, WU Q L, LI J C, et al.Nanomatériaux à base de silicium pour Batteries lithium-ion : une revue.Advanced Energy Materials, 2014, 4(1) : 1300882.
[3] GE M Z, CAO C Y, GILL MB, et al.Progrès récents dans les électrodes à base de silicium : de la recherche fondamentale à la pratique applications.Advanced Materials, 2021, 33(16) : 2004577.
[4] LI P, ZHAO G Q, ZHENG X B, et al. Progrès récents dans le domaine du silicium matériaux d'anode pour des applications pratiques de batteries lithium-ion.Énergie Matériaux de stockage, 2018, 15 : 422.
[5] LIU X H, ZHONG L, HUANG S, et al. En fonction de la taille fracture de nanoparticules de silicium lors de la lithiation.ACS Nano, 2012, 6(2) : 1522.
[6] LUO W, WANG Y X, CHOU S L, et al.Épaisseur critique des composés phénoliques Couche interfaciale de carbone à base de résine pour améliorer la stabilité à long cycle de anodes de nanoparticules de silicium.Nano Energy, 2016, 27 : 255.
[7] DOU F, SHI L Y, CHEN G R, matériaux d'anode composites silicium/carbone pour batteries lithium-ion.Electrochemical Energy Reviews, 2019, 2(1) : 149.
[8] JIA H P, ZOU LF, GAO P Y, et al.Haute performance anodes en silicium rendues possibles par une concentration élevée localisée ininflammable électrolytes.Advanced Energy Materials, 2019, 9(31) : 1900784.
[9] CHOI S H, KWON T W, COSKUN A, et al. Très élastique liants intégrant des polyrotaxanes pour anodes de microparticules de silicium dans le lithium batteries ioniques.Science, 2017, 357 : 279.
[10] LI Z H, ZHANG YP, LIU TF, et al.Anode en silicium à haute efficacité coulombienne initiale par liant trifonctionnel modulé pour Batteries lithium-ion de grande capacité. Énergie avancée Matériaux, 2020, 10(20) : 1903110.
[11] XU Z L, CAO K, ABOUALI S, et al.Etude des mécanismes de lithiation du Si carboné haute performance anodes par microscopie in situ. Matériaux de stockage d'énergie, 2016, 3 : 45.
[12] TEKI R, MONI K D, RAHUL K, et al.Anodes en silicium nanostructurées pour Piles rechargeables au lithium-ion.Petite, 2009, 5(20) : 2236.
[13] XIA S X, ZHANG X, LUO L L, et al. Très stable et une anode métallique Li à ultra haut débit activée par des fibres de carbone fluorées.Small, 2021, 17 : 2006002.
[14] ZHANG S Spectres L, WANG X, HO K S et al.Raman dans un région de fréquence large du silicium poreux de type p.Journal of Applied Physique, 1994, 76(5) : 3016.
[15] HUANG W, WANG Y, LUO G H, et al.Nanotubes de carbone multiparois de pureté 99,9 % par vide recuit à haute température .Carbon, 2003, 41(13) : 2585.
[16] MCDOWELL M T, LEE S W, NIX W D, et al.25e anniversaire article : comprendre la lithiation du silicium et d'autres anodes en alliage pour batteries lithium-ion.Advanced Materials, 2013, 25(36) : 4966.
[17] CLÉ B, MORCRETTE M, TARASCON J Analyse de la fonction de distribution M.Pair et études RMN du solide du silicium électrodes pour batteries lithium-ion : comprendre la (dé)lithiation mécanismes .Journal of American Chemical Society, 2011, 133(3) : 503.
[18] GAO H, XIAO L S, PLUMEL I, et al.Réactions parasitaires dans des particules nanométriques anodes en silicium pour batteries lithium-ion.Nano Letters, 2017, 17(3) : 1512.
[19] CHEN J, FAN X L, LI Q et al. Conception d'électrolytes pour les riches en LiF interfaces électrolyte solide pour permettre des anodes en alliage microdimensionnées hautes performances pour les batteries.Nature Energy, 2020, 5(5) : 386.
[20] ZHANG P, GAO Y Q, RU Q, et al. Préparation évolutive de matériaux poreux Anode nano-silicium/TiN@carbon pour batteries lithium-ion. Surface appliquée Sciences, 2019, 498 : 143829.
[21] SU M R, WAN HF, LIU Y J, et al.Multicouche Composite à base de Si recouvert de carbone comme anode pour les batteries lithium-ion.Poudre Technologie, 2018, 323 : 294.
[22] PU JB, QIN J, WANG Y Z, et al.Synthèse de la structure des micro-nanosphères Composite silicium-carbone comme matériau d'anode pour les batteries lithium-ion. Lettres de physique, 2022, 806 : 140006.
[23] GAO R S, TANG J, YU X L, et al. Un silicium-carbone de type sandwich composite préparé par polymérisation de surface pour un stockage rapide des ions lithium.
Nano énergie, 2020, 70 : 104444.
[24] GONG X H, ZHENG Y B, ZHENG J, et al.Yolk-shell composites silicium/carbone préparés à partir d'un alliage aluminium-silicium comme anode matériaux pour batteries lithium-ion.Ionics, 2021, 27 : 1939.
[25] LIA Y R, WANG R Y, ZHANG J W, et al.Sandwich structure d'anodes en nanofibres de silicium/carbone recouvertes de carbone pour le lithium-ion batteries. Ceramics International, 2019, 45 : 16195.
[26] YANG X M ET ROGACH A L.Techniques électrochimiques dans la recherche sur les batteries : un tutoriel pour non-électrochimistes.Advanced Energy Materials, 2019, 9(25) : 1900747.