Auteur : XIA Qiuying, SUN Shuo, ZAN Feng, XU Jing, XIA Hui
École des matériaux Science et ingénierie, Université des sciences et technologies de Nanjing, Nanjing 210094, Chine
Résumé
Mots clésï¼ LiSiON ; film mince électrolyte; batterie au lithium entièrement solide ; batterie à couche mince
Le développement rapide de l'industrie microélectronique, comme systèmes microélectromécaniques (MEMS), microcapteurs, cartes intelligentes et dispositifs médicaux micro implantables, conduit à une demande croissante de systèmes intégrés stockage d'énergie de taille micrométrique[1,2]. Parmi les technologies de batteries disponibles, La batterie au lithium à couche mince entièrement solide (TFLB) est considérée comme la solution idéale source d'alimentation pour dispositifs microélectroniques en raison de leur haute sécurité, de leur petite taille, conception sous tension, longue durée de vie et faible taux d'autodécharge. Comme l'un des les composants clés du TFLB, l'électrolyte à couche mince à l'état solide joue un rôle essentiel rôle dans la détermination des propriétés de TFLB[3]. Donc, développer un électrolyte à couche mince à semi-conducteurs de haute performance est toujours un objectif important pour le développement de TFLB. À l'heure actuelle, le plus largement utilisé L'électrolyte du TFLB est l'oxynitrure de phosphore de lithium amorphe (LiPON), qui a une conductivité ionique modérée (2Ã10-6 Sâcm-1), une faible conductivité électronique (~10-14 Sâcm-1), une tension large fenêtre (~ 5,5 V) et bonne stabilité de contact avec le lithium [4,5]. Cependant, c'est La conductivité ionique est relativement faible, ce qui entrave le développement futur de TFLB haute puissance pour l’ère à venir de l’Internet des objets (IoT)[6]. Ainsi, c'est il est urgent de développer de nouveaux électrolytes en couches minces à conductivité ionique accrue, ainsi qu'une grande fenêtre de tension et une bonne stabilité de contact avec le lithium pour TFLB nouvelle génération.
Parmi divers matériaux électrolytiques inorganiques à l'état solide, le solide Li2O-SiO2 Le système de solution et leurs phases deutérogéniques ont été identifiés comme potentiellement minces électrolytes en film en raison de leur conduction tridimensionnelle rapide du lithium chaînes[7]. Par exemple, Chen et al.[8] signalé que l'électrolyte solide Li4.4Al0.4Si0.6O4-0.3Li2O substitué par Al a une conductivité ionique élevée de 5,4Ã10-3 Sâcm-1 à 200°. Adnan et coll.[9] a découvert que le composé Li4Sn0.02Si0.98O4 possède une valeur de conductivité maximale de 3,07 × 10-5 Sâcm-1 à température ambiante. Cependant, les travaux antérieurs sur les systèmes électrolytiques Li2O-SiO2 se sont principalement concentrés sur la poudre matériaux à haute cristallinité, alors que des travaux très limités ont été rapportés sur leurs homologues à couches minces amorphes pour TFLB. Puisque TFLB est généralement construit en déposant des films minces de cathode, d'électrolyte et de couche d'anode par couche, le film d'électrolyte doit être préparé à une température relativement basse pour éviter les interactions défavorables entre la cathode et l'électrolyte, ce qui entraîne une fissure et un court-circuit du TFLB[1,2]. Ainsi, développant un électrolyte Li2O-SiO2 avec une caractéristique amorphe préparé à faible la température est importante pour le TFLB. Bien que des travaux récents[6] montrent qu'une conductivité ionique lithium élevée de 2,06 × 10-5 Sâcm-1 peut être obtenue par Li-Si-P-O-N amorphe film mince, sa stabilité de contact avec les électrodes et électrochimiques la stabilité dans TFLB n’a pas encore été étudiée. Il est donc crucial Il est important de développer un électrolyte à couche mince à base de Li2O-SiO2 haute performance et démontrer son application réelle dans TFLB.
Dans ce travail, une couche mince d'oxynitrure de lithium et de silicium amorphe (LiSiON) a été préparé par pulvérisation magnétron radiofréquence (RF) à température ambiante et étudié comme électrolyte à l’état solide pour le TFLB. Le pouvoir de pulvérisation et le les flux de gaz de travail N2/Ar ont été optimisés pour obtenir les meilleures conditions de dépôt pour le film mince LiSiON. De plus, pour démontrer l'applicabilité du électrolyte LiSiON optimisé pour TFLB, une cellule complète MoO3/LiSiON/Li a été construite et son les performances électrochimiques ont été systématiquement étudiées.
1 expérimental
1.1 Préparation des couches minces LiSiON
Des films minces de LiSiON ont été préparés par pulvérisation magnétron RF (Kurt J. Lesker) en utilisant une cible Li2SiO3 (76,2 mm de diamètre) à température ambiante pendant 12 heures. Avant le dépôt, la pression de la chambre a été réduite à moins de 1 × 10-5 Pa. La distance entre la cible et le substrat était de 10 cm. Les échantillons déposés sous une puissance RF de 80, 100 et 120 W avec un débit de 90 sccm N2 sont marqués comme échantillon LiSiON-80N9, LiSiON-100N9 et LiSiON-120N9, respectivement. Et les échantillons déposés sous une puissance RF de 100 W avec un débit de 90 sccm N2 et 10 sccm Ar, 90 sccm N2 et 50 sccm Ar, 50 sccm N2 et 50 sccm Ar sont marqués comme échantillon LiSiON-100N9A1, LiSiON-100N9A5 et LiSiON-100N5A5, respectivement.
Le film MoO3 a été préparé par magnétron réactif à courant continu (DC). pulvérisation cathodique (Kurt J. Lesker) utilisant une cible Mo en métal pur (76,2 mm de diamètre) selon notre précédent rapport[10]. La distance entre la cible et le substrat était de 10 cm et DC la puissance de pulvérisation était de 60 W. Le dépôt a été effectué au niveau du substrat température de 100 â pendant 4 h au débit de 40 sccm Ar et 10 sccm O2, suivi d'un traitement de recuit in-situ à 450° pendant 1 h. LiSiON-100N9A1 a ensuite été déposé sur le film MoO3 comme électrolyte. Après cela, un film de lithium métallique d'environ 2 µm d'épaisseur a été déposé sur le film LiSiON par évaporation thermique sous vide (Kurt J. Lesker). L'étape finale de fabrication impliquait le dépôt d'un collecteur de courant Cu et le processus d'encapsulation.
Les structures cristallines de les échantillons ont été caractérisés par diffraction des rayons X (XRD, Bruker D8 Advance). Les morphologies et microstructures des échantillons ont été caractérisées par champ microscope électronique à balayage à émission (FESEM, FEI Quanta 250F) équipé de spectroscopie de rayons X à dispersion d'énergie (EDS). Les compositions élémentaires du les échantillons ont été analysés par spectrométrie de masse à plasma inductif (ICP-MS, Agilent 7700X). La composition chimique et les informations de liaison des échantillons ont été mesurés par spectroscopie photoélectronique à rayons X (XPS, Escalab 250XI, Thermo Scientifique).
1.4 Mesures électrochimiques
La conductivité ionique de l'électrolyte à couche mince LiSiON a été mesurée utilisant une structure en sandwich Pt/LiSiON/Pt. L'impédance électrochimique spectroscopie (EIS) (de 1000 kHz à 0,1 Hz avec une amplitude potentielle de 5 mV) et des mesures de voltamétrie cyclique (CV) des échantillons ont été effectuées sur le Poste de travail électrochimique biologique VMP3. Charge/décharge galvanostatique (GCD) la mesure du MoO3/LiSiON/Li TFLB a été réalisée à l'aide d'un Neware BTS4000 système de batterie dans une boîte à gants remplie d'argon à température ambiante. Un Sartorius La balance analytique (CPA225D, avec une résolution de 10 μg) a été utilisée pour déterminer la charge massique de l'électrode et la charge massique du film MoO3 est environ 0,4 mgâcm-2.
2 Résultats et discussion
Comme le montre l'image optique insérée dans la figure 1 (a), un Une cible Li2SiO3 a été utilisée pour préparer un film mince LiSiON. Le résultat XRD sur la figure 1(a) révèle que la cible est composée du Li2SiO3 majeur (JCPDS 83-1517) et une phase mineure SiO2. La mesure ICP-MS indique que le niveau atomique le rapport Li : Si est d'environ 1,79 : 1 dans la cible. Transparent amorphe mince Le film a été obtenu pour l'échantillon typique LiSiON-100N9A1 après pulvérisation du cible (Fig. 1 (b)). L'épaisseur de l'échantillon typique LiSiON-100N9A1 mesurée à partir du L'image FESEM en coupe transversale sur la figure 1 (c) est environ 1,2 μm, ce qui indique un taux de croissance d'environ 100 nmâh-1 sous cet état. Comme le montre l'image FESEM vue de dessus sur la figure 1(d), le La surface du film mince LiSiON est très lisse et dense, sans fissures ni trous d'épingle, ce qui en fait un électrolyte solide approprié pour TFLB pour éviter les raccourcis et problème de sécurité.
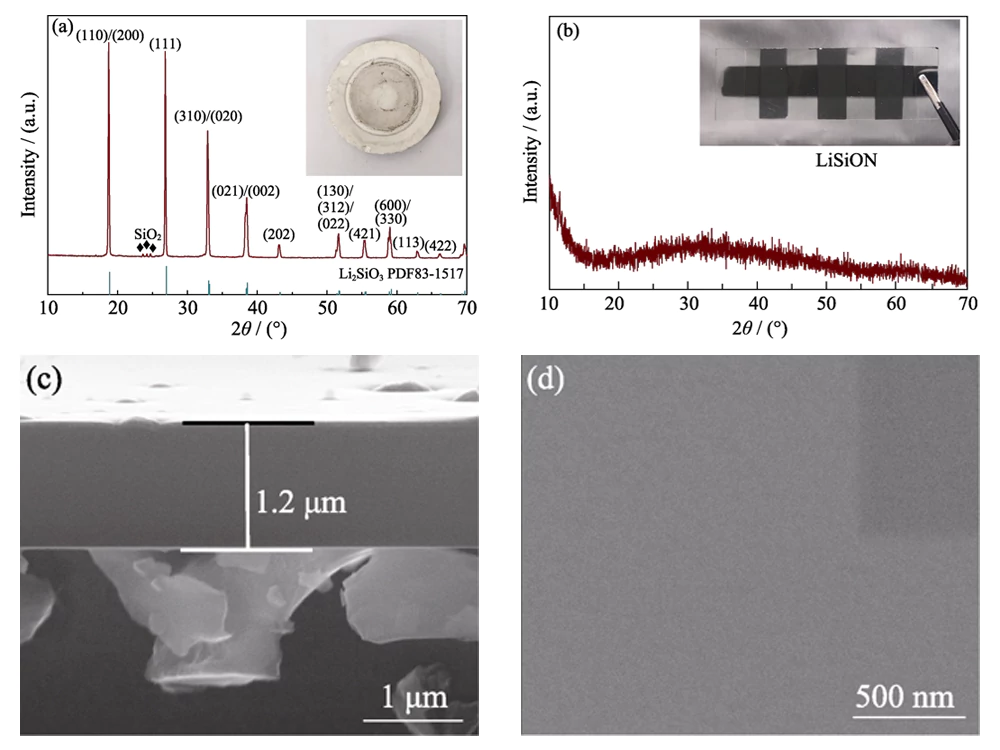
Fig. 1 (a) diagramme XRD et image optique de la cible Li2SiO3 ; (b) Modèle XRD et image optique de échantillon typique LiSiON-100N9A1 ; (c) Images FESEM en coupe transversale et (d) vue de dessus de l'échantillon typique LiSiON-100N9A1
Une analyse XPS a été effectuée pour étudier la composition chimique et informations de liaison de la cible Li2SiO3 et de l'échantillon typique LiSiON-100N9A1. L'enquête XPS scanner les spectres de la Fig. 2(a) révéler la présence d'éléments Li, Si et O dans la cible Li2SiO3 et l'introduction de l'élément N dans le film mince LiSiON. Le rapport atomique de N : Si dans la couche mince de LiSiON est d'environ 0,33 : 1 selon le résultat XPS. Combinaison avec le rapport atomique correspondant (1,51 : 1) obtenu par l'ICP-MS mesure, la stœchiométrie de l'échantillon typique LiSiON-100N9A1 est déterminé comme étant Li1.51SiO2.26N0.33. Comparé au pic unique Si-Si (103,2 eV) dans le Spectre XPS au niveau du cœur Si2p de la cible Li2SiO3 (Fig. 2(b)), un pic supplémentaire de Si-N (101,6 eV) peut être observé à partir du film mince LiSiON, suggérant l'apparition d'une nitruration dans LiSiON [11,12]. Les O1 Spectre XPS de niveau central de la cible Li2SiO3 sur la figure 2(c) montre deux environnements de liaison : 531,5 eV provenant de SiOx et 528,8 eV attribué à Li2O. Après le dépôt, un composant supplémentaire est apparu à 530,2 eV peut être observé avec le film mince LiSiON, qui peut être attribué au non-pontage oxygène (On) dans le silicate[13,14]. Le spectre XPS de niveau noyau N1s de la couche mince LiSiON sur la figure 2(d) peut être déconvolué en trois pics, dont 398,2 eV pour la liaison Si-N, 396,4 eV pour Li3N et 403,8 eV pour les espèces nitrites NO2-, confirmant en outre l'incorporation de N dans le Réseau LiSiON[14,15,16]. Comme l'illustre schématiquement la figure 2(e), le l'incorporation de N dans le réseau LiSiON peut former des liaisons plus réticulées structure, qui est bénéfique pour une conduction rapide des ions lithium[6,17].
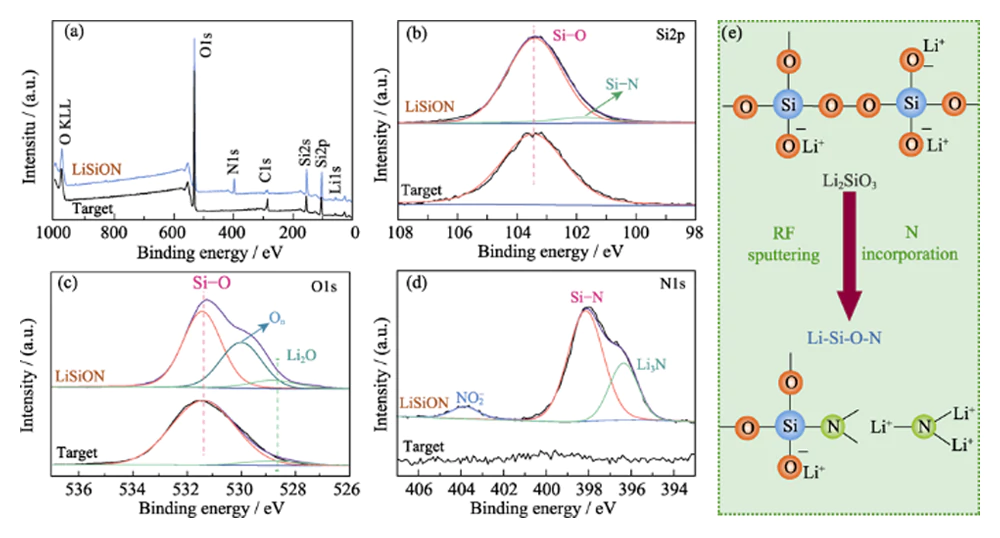
Fig. 2 (a) Survey-scan, (b) niveau de base Si2p, (c) niveau de base O1s, et (d) spectres XPS au niveau de base N1 de la cible Li2SiO3 et de l'échantillon typique LiSiON-100N9A1 ; (e) Illustration schématique du changement de structure partielle de Li2SiO3 à LiSiON avec l'incorporation de N
Pour optimiser la conductivité ionique et la stabilité électrochimique du Films minces LiSiON, divers films minces LiSiON déposés selon différentes pulvérisations puissances, et les flux de gaz de travail ont été comparés en termes de leur conductivités et fenêtres de tension. Les tracés de Nyquist à température ambiante du Les films minces LiSiON sont représentés sur la figure 3 (a) et la structure sandwich Pt/LiSiON/Pt correspondante et le circuit équivalent sont illustré sur la figure 3(b). Comme observé, les tracés de Nyquist présentent un seul demi-cercle et un diélectrique queue de capacité, caractéristique du diélectrique conducteur à couche mince avec un processus de relaxation en vrac pris en sandwich entre des contacts de blocage [17]. L'ionique Les conductivités (Ïi) des couches minces de LiSiON peuvent être calculées à l'aide de l'équation. (1).
Ïi=d/(RA)
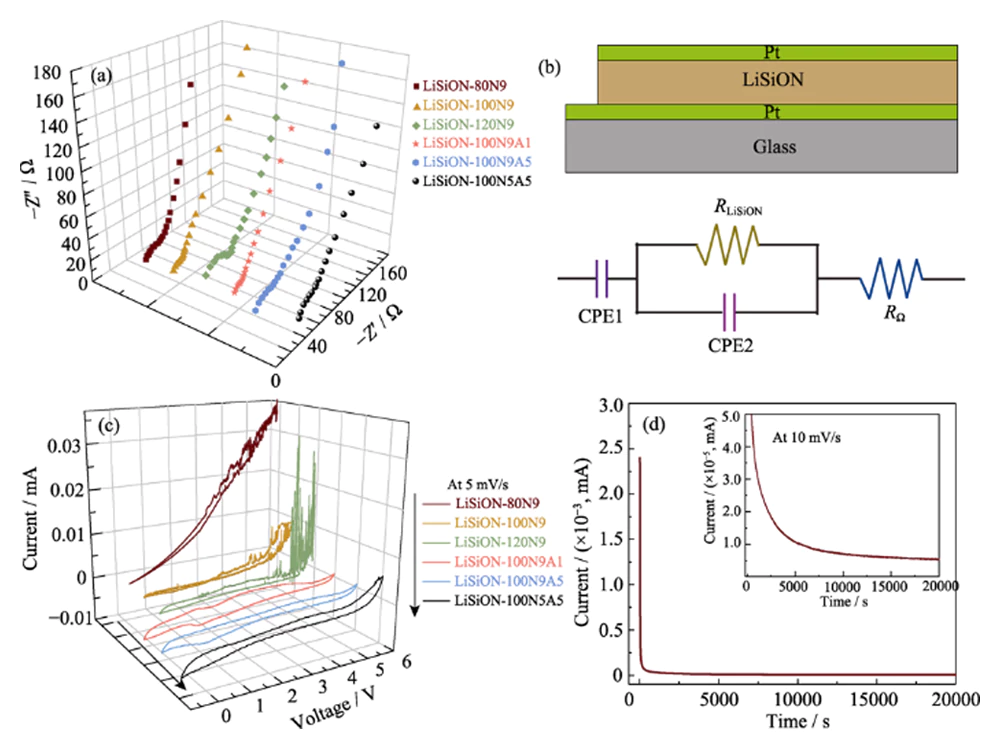
Fig. 3 (a) Spectres de spectroscopie d'impédance électrochimique (EIS) de les couches minces de LiSiON déposées dans différentes conditions ; (b) Schéma illustration de la structure sandwich Pt/LiSiON/Pt et de la structure correspondante circuit équivalent ; (c) Courbes CV des couches minces de LiSiON déposées sous des conditions différentes ; (d) Courbe chronoampérométrie de l'échantillon LiSiON-100N9A1
où d est l'épaisseur du film, A est la surface efficace (environ 1 cm2), et R est la résistance du film estimée à partir du tracé de Nyquist mesuré. Les conductivités ioniques calculées pour ces Les couches minces de LiSiON sont comparées dans le tableau 1. Comme observé, la conductivité ionique de la couche mince de LiSiON déposée à un débit constant de 90 sccm, N2 augmente avec l'augmentation de la puissance de pulvérisation à partir de 80 W à 100 W, puis diminue lorsque la puissance de pulvérisation est encore élevée à 120 W, qui est similaire au rapport précédent sur l'électrolyte LiPON [18]. Une évidence une augmentation des conductivités ioniques peut être observée lorsque le rapport N2 dans le gaz de travail sous une puissance de pulvérisation constante de 100 W est favorisé, ce qui peut être attribué à la quantité accrue d’azote incorporé dans le LiSiON avec un environnement plus favorable au mouvement des ions lithium [5, 18]. Visiblement, les échantillons LiSiON-100N9 et LiSiON-100N9A1 présentent le niveau ionique le plus élevé conductivités de 7,1 × 10-6 et 6,3 × 10-6 Sâcm-1, respectivement, qui sont évidemment plus élevées que le célèbre LiPON (~2Ã10-6 Sâcm-1), le LiNbO3 amorphe (~1Ã10-6 Sâcm-1)[19], le LiBON (2,3Ã10- 6 Sâcm-1)[20], Li-V-Si-O (~1Ã10-6 Sâcm-1)[21], Li-La-Zr-O (4Ã10-7 Sâcm-1)[22] et Li-Si-P-O (1,6 × 10-6 Sâcm-1)[23] films d'électrolyte, révélant que l'amorphe Le film mince LiSiON est un candidat compétitif comme électrolyte pour le TFLB. Le haut La conductivité ionique du film mince LiSiON peut être attribuée à l'incorporation de N dans le film mince et la formation de liaisons Si-N au lieu de liaisons Si-O, conduisant à un réseau anionique plus réticulé pour le lithium-ion facile mobilité[17, 24]. Les fenêtres de tension électrochimiquement stables du LiSiON les films minces ont été évalués par mesure CV à une vitesse de balayage de 5 mVâs-1 avec tension jusqu'à 5,5 V. Il convient de souligner que l'impact du dépôt L'état de la fenêtre de tension des films LiSiON varie, ce qui ne peut pas être expliqué par un mécanisme clair actuellement puisqu'il n'y a pas de recherches pertinentes dans des rapports précédents sur l'électrolyte à couche mince [18,24-25]. Néanmoins, par rapport à la Fig. 3(c) et Tableau 1, les échantillons LiSiON-100N9A1 et LiSiON-100N5A5 montrent la tension la plus large fenêtres de ~5,0 et ~5,2 V, respectivement, proches de celles du LiPON électrolyte. Par conséquent, en prenant à la fois la conductivité ionique et la fenêtre de tension en considération, l'échantillon LiSiON-100N9A1 a été choisi pour une enquête plus approfondie et la fabrication de cellules complètes. Pour explorer le transfert d’ions lithium nombre (Ïi) et la conductivité électronique (Ïe) de l'échantillon LiSiON-100N9A1, la chronoampérométrie a ensuite été réalisée à tension constante de 10 mV (Fig. 3 (d)). Le Ïi peut être calculé par l'équation. (2).
Ïi=(Ib-Ie)/Ib
où Ib est le courant de polarisation initial et Ie est le courant constant état actuel[18]. Le Ïi a été calculé à 0,998, ce qui est proche de 1, indiquant que la conduction des ions lithium est absolument dominante dans l'électrolyte. Le Ïi est déterminé par un effet mixte du conduction des ions et des électrons [24], qui peut être exprimée par l'équation. (3).
Ïi=Ïi/(Ïi+Ïe)
Ainsi, le Ïe de l'échantillon LiSiON-100N9A1 est calculé comme étant 1,26 × 10-8 Sâcm-1, ce qui est négligeable par rapport à sa conductivité ionique.
Tableau 1 Comparaison des conductivités et de la tension des ions lithium fenêtres de couches minces LiSiON déposées dans différentes conditions
|
Échantillon |
Conductivités des ions lithium |
Tension |
|
LiSiON-80N9 |
4,6 |
~2,0 |
|
LiSiON-100N9 |
7.1 |
~3,9 |
|
LiSiON-120N9 |
2,5 |
~4.2 |
|
LiSiON-100N9A1 |
6,3 |
~5,0 |
|
LiSiON-100N9A5 |
3,0 |
~4,6 |
|
LiSiON-100N5A5 |
2,9 |
~5.2 |
Pour vérifier la faisabilité de l'échantillon optimisé LiSiON-100N9A1 pour L'application TFLB, MoO3/LiSiON/Li TFLB a ensuite été fabriquée. La section transversale Image FESEM et images cartographiques EDS correspondantes du MoO3/LiSiON/Li TFLB sont illustrés à la figure 4 (a). Comme observés, la cathode MoO3 (environ 1,1 μm d'épaisseur) et l'anode Li sont bien séparés par l'électrolyte LiSiON, et l'électrolyte LiSiON a interfaces de contact étroites avec la cathode et l'anode. Figure 4(b) affiche la courbe CV typique du TFLB à une vitesse de balayage de 0,1 mVâs-1 entre 1,5-3,5 V, qui montre une paire de pics redox bien définis à environ 2,25 et 2,65 V, correspondant à l’insertion et à l’extraction des ions lithium dans le MoO3[10]. Figure 4(c) représente les 3 courbes de charge/décharge galvanostatiques initiales du TFLB à une densité de courant de 50 mAâg-1 (20 μAâcm-2, basée sur la masse du film MoO3). Comme observé, le TFLB offre les capacités de charge/décharge initiales de 145/297 mAhâg-1 (58/118,8 μAhâcm-2). Après le 2ème cycle, comportement de cyclage stable avec une réversibilité élevée une capacité spécifique de 282 mAhâg-1 a été atteinte par le TFLB. La performance tarifaire de le TFLB à différentes densités de courant est représenté sur la figure 4 (d). Le perte de capacité irréversible du TFLB au cours des premiers cycles à faible courant la densité peut être attribuée à une transition de phase irréversible dans le MoO3 dérivé par insertion de lithium[26]. Capacités de décharge stables d'environ 219, 173, 107 et 50 mAhâg-1 sont observés à 100, 200, 400 et 800 mAâg-1, respectivement, démontrant une bonne capacité de débit. Pour évaluer la stabilité électrochimique du TFLB, la performance du cycle a en outre été réalisée à une densité de courant de 200 mAâg-1 (Fig. 4(e)). Le TFLB peut conserver 78,1 % de sa capacité de décharge initiale après 200 cycles, et l'efficacité coulombienne est proche de 100 % pour chaque cycle, révélant un niveau acceptable stabilité électrochimique de l'électrolyte LiSiON. Les mesures EIS ont été effectué en outre à une tension en circuit ouvert pour étudier le interface électrolyte/électrode dans le TFLB à différents numéros de cycle, et le Les tracés de Nyquist correspondants avec un circuit équivalent sont représentés sur la figure 4 (f). Comme observé, le MoO3/LiSiON/Li TFLB montre un spectre EIS similaire qui consiste en de deux demi-cercles dans la région des hautes fréquences à l'état frais à celle du MoO3/LiPON/Li TFLB dans nos travaux précédents[10], indiquant que la résistance interfaciale Li/LiSiON est négligeable par rapport à celle du Interface LiSiON/MoO3 [20]. Le premier petit demi-cercle des parcelles de Nyquist est attribué à la conduction ionique des ions Li+ dans l'électrolyte LiSiON, tandis que le le deuxième grand demi-cercle correspond au processus de transfert de charge au Interface LiSiON/MoO3 [27,28]. Il est à noter que le premier petit demi-cercle est rarement changements au cours des cycles, indiquant la relativement bonne stabilité cyclique de l'électrolyte LiSiON. Cependant, le deuxième demi-cercle s'agrandit progressivement à mesure que le nombre de cycles évolue, révélant l'augmentation de l'interface LiSiON/MoO3 résistance pendant le cyclisme, ce qui pourrait être la principale raison de la capacité évanouissement du TFLB[29]. Il convient de mentionner que ce travail a été couronné de succès adopte l'électrolyte LiSiON pour construire TFLB et démontre les bons contact interfacial du LiSiON avec la cathode MoO3 et l'anode au lithium pour le première fois. De plus, la grande capacité spécifique, la bonne capacité de débit et les performances de cycle acceptables du MoO3/LiSiON/Li TFLB démontrent que le LiSiON le film mince est bien applicable comme électrolyte pour TFLB.
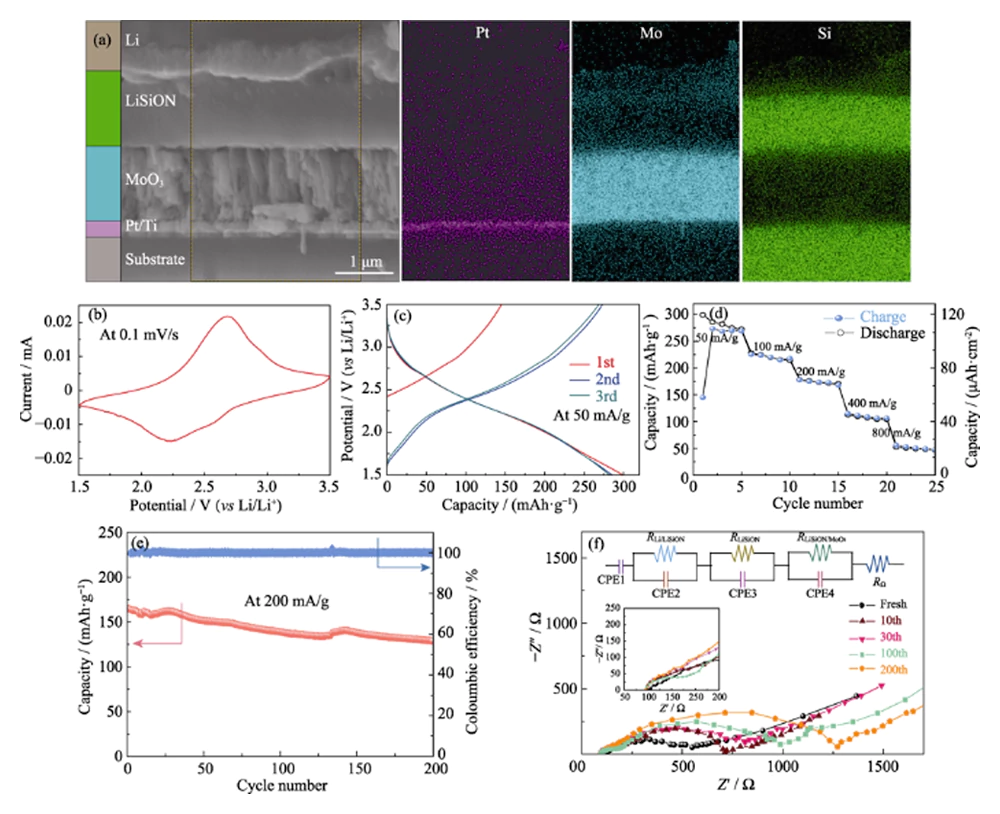
Fig. 4 (a) Image FESEM en coupe transversale et cartographie EDS correspondante images du MoO3/LiSiON/Li TFLB ; (b) Courbe CV typique, (c) trois courbes de charge/décharge initiales, (d) taux performances, (e) performances du cycle et (f) spectres EIS à différents cycles numéros du MoO3/LiSiON/Li TFLB avec échantillon LiSiON-100N9A1 comme électrolyte
3 conclusions
En résumé, l’électrolyte à couche mince amorphe LiSiON a été testé avec succès. préparé par pulvérisation magnétron RF en utilisant une cible Li2SiO3 avec un flux de gaz N2/Ar. Le film mince LiSiON optimisé déposé sous une puissance RF de 100 W au flux de 90 sccm N2 et 10 sccm Ar possèdent une surface lisse, une structure dense, une teneur élevée en ions conductivité (6,3 × 10-6 Sâcm-1) et large fenêtre de tension (5 V), ce qui en fait un produit prometteur Matériau électrolytique pour TFLB. Plus important encore, en utilisant le LiSiON électrolyte, un MoO3/LiSiON/Li TFLB a été démontré avec succès pour le première fois avec une capacité spécifique élevée (282 mAhâg-1 à 50 mAâg-1), de bonnes performances de débit (50 mAhâg-1 à 800 mAâg-1), et une stabilité de cycle acceptable (rétention de capacité de 78,1 % après 200 cycles). Ce travail devrait apporter de nouvelles opportunités pour développer des Performance TFLB en utilisant un électrolyte à couche mince à base de Li2O-SiO2.
Références
[1] MOITZHEIM S, PUT B, VEREECKEN P M. Avancées dans les batteries Li-ion à couche mince 3D. Interfaces de matériaux avancés, 2019,6(15):1900805.
[2] XIA Q, ZHANG Q, SUN S et al. Réseaux de nanofeuilles LixMnO2 à intercroissance tunnel comme cathode 3D pour microbatteries au lithium à couches minces entièrement solides hautes performances. Matériaux avancés, 2021,33(5):2003524.
[3] DENG Y, EAMES C, FLEUTOT B, et al. Amélioration de la conductivité des ions lithium dans les électrolytes solides à conducteur superionique au lithium (LISICON) grâce à un effet polyanion mixte. Matériaux et interfaces appliqués ACS, 2017,9(8):7050-7058.
[4] BATES JB, DUDNEY NJ, GRUZALSKI GR, et al. Fabrication et caractérisation de couches minces d'électrolyte de lithium amorphe et de batteries rechargeables à couches minces. Journal des sources d'énergie, 1993,43(1/2/3):103-110.
[5] BATES J. Propriétés électriques des films minces d'électrolyte de lithium amorphe. Solid State Ionics, 1992,53(56):647-654.
[6] FAMPRIKIS T, GALIPAUD J, CLEMENS O, et al. Dépendance à la composition de la conductivité ionique dans les électrolytes à couches minces LiSiPO(N) pour batteries à semi-conducteurs. ACS Matériaux énergétiques appliqués, 2019,2(7):4782-4791.
[7] DENG Y, EAMES C, CHOTARD JN, et al. Aperçu structurel et mécanistique de la conduction rapide des ions lithium dans les électrolytes solides Li4SiO4-Li3PO4. Journal de l'American Chemical Society, 2015,137(28):9136-9145.
[8] CHEN R, SONG X. La conductivité ionique des électrolytes solides pour les systèmes Li4+xMxSi1-xO4-yLi2O (M=Al, B). Journal de la Société chimique chinoise, 2002, 49 : 7-10.
[9] ADNAN S, MOHAMED N S. Effets de la substitution Sn sur les propriétés de l'électrolyte céramique Li4SiO4. Solid State Ionics, 2014, 262 : 559-562.
[10] SUN S, XIA Q, LIU J et al. Réseaux de nanoflacons d'α-MoO3-x autonomes déficients en oxygène comme cathode 3D pour les batteries avancées au lithium à couches minces entièrement solides. Journal of Materiomics, 2019,5(2):229-236.
[11] DING W, LU W, DENG X, et al. Une étude XPS sur la structure du film SiNx déposé par pulvérisation magnétron ECR micro-ondes. Acta Physica Sinica, 2009,58(6):4109-4116.
[12] KIM H, KIM Y. Nitruration partielle de Li4SiO4 et conductivité ionique de Li4. 1SiO3. 9N0. 1Ceramics International, 2018,44(8):9058-9062.
[13] MARIKO M, HIDEMASA K, TOMOYUKI O, et al. Analyse des anodes SiO pour batteries lithium-ion. Journal de la Société Electrochimique, 2005,152(10):A2089.
[14] FINGERLE M, BUCHHEIT R, SICOLO S, et al. Formation de couches de réaction et de charge d'espace à l'interface LiCoO2-LiPON : aperçu de la formation de défauts et de l'alignement du niveau d'énergie des ions par une approche combinée science-simulation de surface. Matériaux chimiques, 2017,29(18):7675-7685.
[15] WEST W, HOOD Z, ADHIKARI S, et al. Réduction de la résistance au transfert de charge à l'interface électrolyte solide-électrode par dépôt laser pulsé de films à partir d'une source cristalline de Li2PO2N. Journal des sources d'énergie, 2016, 312 : 116-122.
[16] SICOLO S, FINGERLE M, HAUSBRAND R, et al. Instabilité interfaciale du LiPON amorphe par rapport au lithium : une théorie fonctionnelle de la densité combinée et une étude spectroscopique. Journal des sources d'énergie, 2017, 354 : 124-133.
[17] WUF, LIU Y, CHEN R, et al. Préparation et performances d'un nouvel électrolyte à couche mince Li-Ti-Si-P-O-N pour batteries au lithium à couche mince. Journal des sources d'énergie, 2009,189(1):467-470.
[18] PUT B, VEREECKEN M, MEERSSCHAUT J, et al. Caractérisation électrique de couches LiPON ultrafines pulvérisées par RF pour les batteries à l'échelle nanométrique. Matériaux et interfaces appliqués ACS, 2016,8(11):7060-7069.
[19] NIINOMI H, MOTOYAMA M, IRIYAMA Y. Li+ Conduction dans des films Li-Nb-O déposés par une méthode Sol-Gel. Solid State Ionics, 2016, 285 : 13-18.
[20] SONG S, LEE K, PARK H. Microbatteries flexibles tout solide haute performance à base d'électrolyte solide d'oxynitrure de lithium et de bore. Journal des sources d'énergie, 2016, 328 : 311-317.
[21] OHTSUKA H, OKADA S, YAMAKI J. Batterie à semi-conducteurs avec film mince d'électrolyte solide Li2O-V2O5-SiO2. Solid State Ionics, 1990, 40-41 : 964-966.
[22] Kalita D, Lee S, Lee K et al. Propriétés de conductivité ionique de l'électrolyte solide amorphe Li-La-Zr-O pour les batteries à couches minces. Solid State Ionics, 2012, 229 : 14-19.
[23] SAKURAI Y, SAKUDA A, HAYASHI A, et al. Préparation de films minces amorphes Li4SiO4-Li3PO4 par dépôt laser pulsé pour batteries secondaires au lithium tout solide. Solid State Ionics, 2011, 182 : 59-63.
[24] TANG, WUF, LI L et al. Préparation par pulvérisation magnétron d'électrolytes à couches minces à base de lithium-aluminium-phosphate de titane incorporés à l'azote pour batteries lithium-ion entièrement solides. Le Journal de Chimie Physique C, 2012,116(5):3817-3826.
[25] YU X, BATES JB, JELLISON G, et al. Un électrolyte de lithium en couche mince stable : l'oxynitrure de lithium et de phosphore. Journal de la Société Electrochimique, 1997,144(2):524.
[26] KIM H, COOK J, LIN H et al. Les lacunes en oxygène améliorent les propriétés de stockage de charge pseudocapacitive du MoO3-x. Matériaux naturels, 2017,16 : 454-460.
[27] SONG H, WANG S, SONG X, et al. Batteries lithium-air entièrement solides à énergie solaire fonctionnant à des températures extrêmement basses. Sciences de l'énergie et de l'environnement, 2020,13(4):1205-1211.
[28] WANG Z, LEE J, XIN H et al. Effets de la couche interfaciale d'électrolyte cathodique (CEI) sur le cycle à long terme des batteries à couches minces entièrement solides. Journal des sources d'énergie, 2016, 324 : 342-348.
[29] QIAO Y, DENG H, HE P, et al. Une cellule lithium-métal de 500 Wh/kg à base de redox anionique. Joule, 2020,4(6):1311-1323.