Électrolyte polymère composite MOF/poly(oxyde d'éthylène) pour batterie au lithium à l'état solide
LIANG Fengqing, WEN Zhaoyin
1. CAS Key Laboratory of Materials for Energy Conversion, Shanghai Institute of Ceramics, Chinese Academy of Sciences, Shanghai 200050, Chine
2. Centre de science des matériaux et de génie optoélectronique, Université de l'Académie chinoise des sciences, Pékin 100049, ChineAbstrait
Les électrolytes polymères solides (SPE) avec une flexibilité et une aptitude au traitement élevées permettent la fabrication de batteries à semi-conducteurs sans fuite avec des géométries variées. Cependant, les SPE souffrent généralement d'une faible conductivité ionique et d'une mauvaise stabilité avec les anodes au lithium métallique. Ici, nous proposons un matériau de structure organométallique (MOF) de taille nanométrique (UiO-66) comme charge pour l'électrolyte polymère poly(oxyde d'éthylène) (PEO). La coordination de l'UiO-66 avec l'oxygène dans la chaîne PEO et l'interaction entre l'UiO-66 et le sel de lithium améliorent significativement la conductivité ionique (3,0×10 -5 S/cm à 25 ℃, 5,8×10 -4 S/cm à 60 ℃ ) et le nombre de transfert de Li + (0,36), élargissent la fenêtre électrochimique à 4,9 V (vs Li +/Li), améliorent la stabilité avec l'anode au lithium métallique. En conséquence, les cellules symétriques Li préparées peuvent fonctionner en continu pendant 1000 h à 0,15 mA∙cm -2, 60 ℃.Mots-clés: électrolyte composite ; poly(oxyde d'éthylène) ; matériau de charpente organo-métallique ; batterie au lithium métal
La technologie des batteries au lithium peut être améliorée en remplaçant les électrolytes liquides actuellement utilisés par des électrolytes polymères solides (SPE), permettant la fabrication de structures à semi-conducteurs flexibles, compactes, stratifiées, exemptes de fuites et disponibles dans des géométries variées. Les SPE explorées à ces fins sont des membranes polymères conductrices ioniques formées par des complexes entre le sel de lithium (LiX) et un polymère de haut poids moléculaire contenant des groupes de coordination Li+, comme le poly(oxyde d'éthylène) (PEO). Dans les électrolytes polymères PEO, avec le polymère à l'état amorphe, Li + est transporté rapidement avec la relaxation locale et le mouvement segmentaire de la chaîne polymère, mais le PEO a tendance à cristalliser en dessous de 60 ℃. Ainsi la conductivité des électrolytes polymères PEO n'atteint des valeurs pratiquement utiles (de l'ordre de 10-4 S/cm) qu'à la température supérieure à 60 ℃. De nombreuses tentatives pour diminuer la cristallinité du polymère ont été faites pour améliorer la conductivité des électrolytes polymères, y compris le mélange avec d'autres copolymères, l'ajout de plastifiants et le dopage de particules inorganiques. L'incorporation de matériaux inorganiques dans la matrice polymère est l'approche la plus réussie, qui améliore la conductivité ionique ainsi que la stabilité électrochimique et les propriétés mécaniques. Ces matériaux inorganiques comprennent principalement des matériaux non conducteurs, tels que SSZ-13, Al2O3, SiO2, et des matériaux conducteurs, tels que Li0.33La0.57TiO3, Li6.75La3Zr1.75Ta0.25O12 et Li1.5Al0.5Ge1.5(PO4)3 . Les recherches ont montré que les nanoparticules avec des propriétés de surface acides de Lewis peuvent stimuler plus efficacement la dissociation du sel de lithium et réduire la cristallinité du PEO, améliorant ainsi la conductivité ionique. Cependant, le mauvais contact entre la nanoparticule inorganique et le PEO pour la bande interdite d'énergie de surface conduit généralement à une dispersion inhomogène. Les charges céramiques greffées avec des brosses moléculaires et modifiées avec de la dopamine sont dotées de propriétés inorganiques-organiques. Ils devraient améliorer la miscibilité avec le PEO, améliorant à l'avenir la conductivité ionique et la stabilité des électrolytes polymères.
Les cadres métal-organiques (MOF) constitués d'amas d'ions métalliques et de lieurs organiques sont des matériaux nanoporeux typiques, qui possèdent une propriété hybride inorganique-organique et une surface spécifique élevée, constituant ainsi des charges idéales pour les électrolytes polymères. En 2013, Yuan et al. utilisé Zn4O (1,4-benzènedicarboxylate) 3 structure métal-organique (MOF-5) comme charge pour l'électrolyte PEO obtenant une conductivité ionique élevée de 3,16 × 10-5 S∙cm-1 (25 ℃) en raison de la dispersion uniforme. Mais les faibles liaisons de coordination métal-organique du MOF-5 sont faciles à attaquer, entraînant une transition cristalline ou un effondrement de la structure et une mauvaise stabilité de la batterie au lithium.
Dans ce travail, l'UiO-66 de taille nanométrique, l'un des MOF étudiés de manière approfondie, a été introduit comme charge dans l'électrolyte PEO. L'UiO-66 avec une stabilité hydrothermique et chimique exceptionnelle ne contient pas de métaux de transition qui fournissent des centres actifs redox, de sorte que la conduction électronique peut être évitée lors du contact avec le Li métallique.
1 Expérimental
1.1 Synthèse d'UiO-66 de taille nanométrique
UiO-66 de taille nanométrique a été synthétisé selon la synthèse en deux étapes rapportée. (1) 207 mg de ZrCl4 (98 %, Aladdin) ont été dissous dans 40 mL de N,N-diméthylformamide (DMF) (99,9 %, Aladdin) sous agitation, et la solution a été chauffée à environ 120 °C pendant 2 h. Ensuite, 1 ml d'acide acétique a été ajouté et agité pendant 0,5 h supplémentaire à 120 ℃. (2) 147 mg d'acide 1,4-benzènedicarboxylique (H2BDC) (99 %, Aladdin) ont été ajoutés à la solution. Et le mélange résultant a été introduit dans un autoclave en acier inoxydable doublé de téflon de 50 ml et placé dans une étuve à 120 ℃ pendant 24 h. Après refroidissement à température ambiante, les précipités obtenus ont été centrifugés, lavés avec du DMF, purifiés dans du méthanol puis séchés à 60°C sous vide pendant 24 h.
1.2 Préparation des électrolytes polymères composites UiO-66/PEO (CPE)
Le PEO (Mw = ~ 600 000, 99,9 %, Aladdin) a été séché à 50 ℃, et le bis(trifluorométhanesulfonyl)imide de lithium (LiTFSI) (99 %, Aladdin) a été séché à 100 ℃ pendant 24 h sous vide et stocké dans un Ar- boite à gants remplie. Tout d'abord, LiTFSI a été dissous dans de l'acétonitrile anhydre, et UiO-66 et PEO ont été ajoutés sous agitation magnétique pour donner une solution homogène, dans laquelle le rapport molaire EO : Li+ a été maintenu à 16 : 1, et la teneur en UiO-66 de taille nanométrique les charges ont été conçues pour être 0, 5%, 10%, 15%, 20%, 25%, en nommant les électrolytes correspondants SPE, CPE- (5%, 10%, 15%, 20%, 25%). Ensuite, la solution a été coulée sur une matrice de polytétrafluoroéthylène pour volatiliser le solvant à température ambiante. Enfin, les membranes ont été séchées à 60°C pendant 12 h sous vide pour volatiliser le solvant résiduel.
1.3 Caractérisation des échantillons
Les structures cristallines des ingrédients ont été recueillies par diffraction des rayons X (DRX) avec un rayonnement Cu-Kα (λ=0,1542 nm) à température ambiante (2θ=5°-50°) avec un pas de 0,1 (°)/s. Les morphologies de structure de UiO-66 et de CPE ont été révélées par la microscopie électronique à balayage (SEM, Hitachi, S-3400N).
1.4 Mesure électrochimique et assemblage des cellules
La conductivité ionique a été mesurée à une température de 25 à 80 ℃ dans une cellule symétrique avec des électrodes en acier inoxydable (SS) par l'analyse d'impédance AC (Autolab, modèle PGSTAT302N) dans la gamme de fréquences de 1 Hz à 1 MHz et à une amplitude de 50 mV . La voltamétrie à balayage linéaire (LSV) a été utilisée pour examiner la fenêtre électrochimique dans les cellules SS/électrolyte/Li, conduisant de 3 à 5,5 V à une vitesse de balayage de 10 mV/s. Le nombre de transfert de Li+ (t+) a été testé dans des cellules Li/électrolyte/Li et calculé selon t+ = I∞( Δ V−I0R0)I0( Δ V−I∞R∞), où ΔV est la tension de polarisation CC appliquée (10 mV), I0 et I∞ sont respectivement les valeurs de courant initial et stable pendant la polarisation. R0 et R∞ sont les valeurs de résistance avant et après polarisation, respectivement. Pour la capacité d'inhibition du test de croissance des dendrites de lithium,
2 Résultats et discussion
UiO-66 ([Zr6O4(OH)4(BDC)6], où BDC2- est le radical acide 1,4-benzènedicarboxylique) avec une structure de réseau cubique à faces centrées (fcc) (Fig. 1(a)) constituée de Zr6O4 Les clusters (OH) 4 et les lieurs BDC possèdent des cages octaédriques de 1, 2 nm et tétraédriques de 0, 75 nm. La figure 1 (b) est l'image SEM de l'UiO-66 tel que préparé où les cristaux sont de forme sphérique avec une taille de 80 à 150 nm. L'UiO-66 a été incorporé dans l'électrolyte polymère PEO-LiTFSI pour fabriquer un électrolyte composite par une simple méthode de coulée en solution. Une surface lisse d'électrolyte composite est observée sur la figure 1 (c), indiquant que les charges UiO-66 de taille nanométrique sont uniformément réparties dans la matrice PEO en raison de la propriété hybride inorganique-organique de UiO-66.
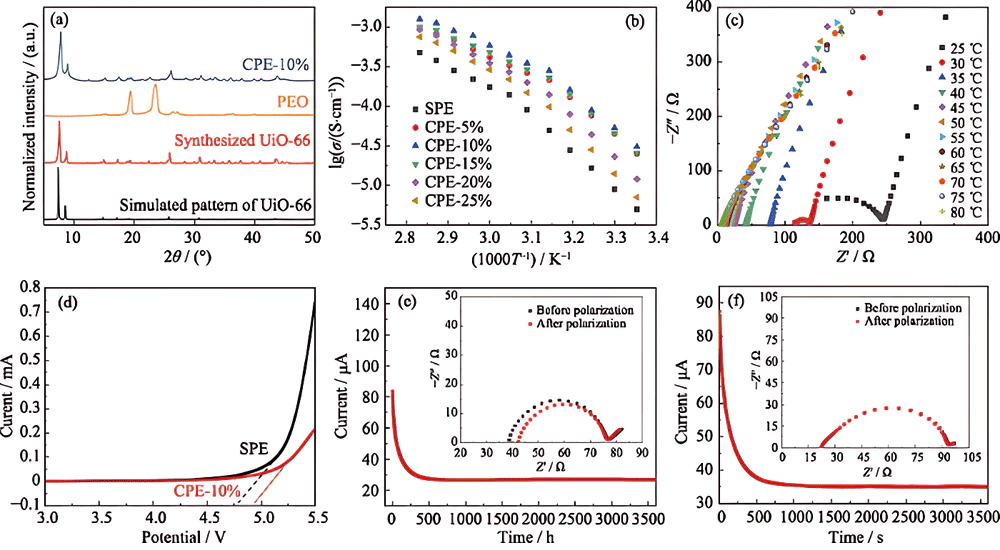
Il est clair qu'une conductivité ionique plus élevée est obtenue avec l'ajout de l'UiO-66 de taille nanométrique dans l'électrolyte PEO. Comme la coordination de [Zr6O4(OH)4]12+ avec l'oxygène dans le PEO réduit la cristallinité de la chaîne PEO pour favoriser le mouvement segmentaire de la chaîne polymère, ce qui est prouvé par le schéma XRD de CPE-10% par rapport au PEO (Fig. 2(a)). De plus, l'interaction entre [Zr6O4(OH)4]12+ et TFSI- favorise la dissociation du sel de lithium. L'augmentation de la teneur en charges UiO-66 en dessous d'une certaine valeur s'accompagne de la promotion de la conductivité ionique. Cependant, l'augmentation supplémentaire des charges réduit la conductivité ionique en raison des effets de dilution et de blocage. Le CPE-10% montre la conductivité ionique la plus élevée (3,0 × 10-5 S/cm à 25 ℃, 5,8 × 10-4 S/cm à 60 ℃), tandis que la conductivité ionique du SPE n'est que de 5,0 × 10-6 S /cm à 25 ℃ et 1,7×10-4 S/cm à 60 ℃. Les propriétés conductrices de CPE-10% à une température de 25 à 80 ℃ ont également été étudiées par spectroscopie d'impédance AC, et les tracés de Nyqiust sont présentés sur la figure 2 (c). Il montre que la valeur de l'impédance diminue avec l'augmentation de la température.
L'effet de UiO-66 sur la fenêtre électrochimique de l'électrolyte PEO a été étudié par LSV à 60 ℃. Comme le montre la figure 2 (d), la plate-forme stable de CPE-10% à environ 4, 9 V est supérieure à celle de SPE, en raison de la coordination de UiO-66 avec l'oxygène qui favorise la tension d'oxydation du PEO et le fait que Zr(IV) dans UiO-66 est difficile à réduire. Ainsi, on s'attend à ce que le CPE soit adapté à une batterie au lithium correspondant à une cathode positive haute tension. Le nombre de transfert de Li + est un paramètre important fournissant des informations sur la contribution de la capacité de vitesse de Li + dans l'électrolyte à l'état solide. Les courbes temps-courant après 10 mV de polarisation CC pour SPE et CPE-10% sont présentées à la Fig. 2 (ef). Le t+ du CPE-10 % est de 0,36 et supérieur à celui du SPE (0,25).
La stabilité électrochimique à long terme contre l'anode au lithium est une caractéristique importante de l'électrolyte à l'état solide, qui pourrait être mesurée par placage galvanostatique au lithium et rayures dans des cellules Li/électrolyte/Li symétriques. La figure 3(a) montre une fenêtre de tension avec une densité de courant constante de 0,15 mA∙cm-2 pendant 1 h à chaque cycle à 60 ℃. Sur la figure 3 (b), la cellule symétrique Li/CPE-10 %/Li présente une plage de tension de charge-décharge comprise entre -0,058 et 0,06 V au premier cycle, puis diminue légèrement à -0,048-0,053 V après 900 cycles, indiquant la bonne stabilité électrochimique entre le CPE et le lithium métallique et l'excellente capacité du CPE à bloquer la croissance des dendrites de lithium. Cette capacité peut être attribuée aux facteurs suivants : (1) la résistance mécanique améliorée ; (2) une fraction d'anions immobilisés par [Zr6O4(OH)4]12+ stimulant le placage et le striping Li uniformes. En revanche, la tension de charge-décharge de la cellule symétrique Li/SPE/Li varie de -0,25 à 0,37 V au premier cycle (Fig. 3(b)) et la batterie présente un court-circuit après 104 h. Des performances de cycle aussi médiocres pourraient être imputées à un placage et à une bande de Li inégaux, qui résultent du faible t + de SPE possédant beaucoup d'anions libres.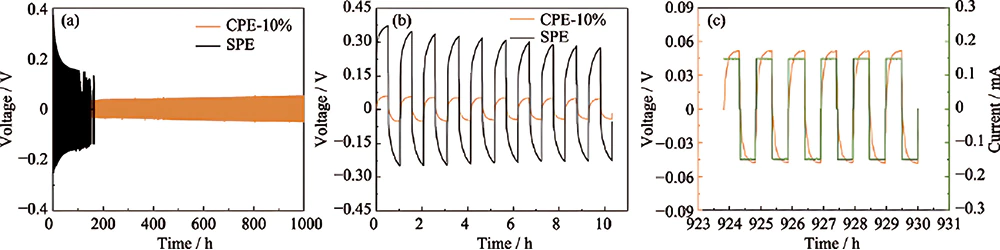
3Conclusion
En résumé, l'électrolyte à base de PEO avec UiO-66 comme charge a été fabriqué via la technique de coulée en solution. Le CPE-10% tel qu'obtenu montre des conductivités ioniques élevées de 3,0 × 10-5 S/cm à 25 ℃ et 5,8 × 10-4 S/cm à 60 ℃, qui sont attribuées aux facteurs suivants : (1) le faible cristallinité du PEO due à la coordination de [Zr6O4(OH)4]12+ avec l'oxygène dans la chaîne PEO ; (2) l'interaction entre TFSI- et [Zr6O4(OH)4]12+ favorisant la dissociation du sel de lithium. Le nombre de transfert plus élevé de Li+ (0,36) est dû à l'immobilité d'une fraction d'anion qui bénéficie également de la capacité de supprimer la croissance des dendrites de lithium du CPE. La résistance mécanique améliorée et l'excellente stabilité électrochimique du CPE contre le lithium métal permettent de supprimer efficacement la croissance des dendrites de lithium,Plus de matériaux pour batteries lithium-ion de TOB New Energy