Préparation de nanocubes Fe4[Fe(CN)6]3 de haute qualité : comme matériau de cathode pour une batterie ion-sodium aqueuse
WANG Wu-Lian. Nanocubes Fe4[Fe(CN)6]3 de haute qualité : synthèse et performances électrochimiques comme matériau de cathode pour une batterie aqueuse sodium-ion. Journal des matériaux inorganiques[J], 2019, 34(12): 1301-1308 doi:10.15541/jim20190076
Test de performance électrochimique de nanocubes Fe4[Fe(CN)6]3 de haute qualité
Tout d'abord, les performances électrochimiques de HQ-FeHCF et LQ-FeHCF dans l'électrolyte Na-H2O-PEG ont été testées à l'aide d'un système à trois électrodes. La figure 4 (a) montre les courbes de voltamétrie cyclique de HQ-FeHCF et LQ-FeHCF dans l'électrolyte Na-H2O-PEG avec une vitesse de balayage de 1 mV s-1. On peut clairement observer sur la figure que deux paires de pics redox indépendants sont apparus dans HQ-FeHCF, indiquant que deux réactions redox se sont produites, correspondant à l'intercalation/désintercalation réversible de deux Na+. La première paire de pics redox est apparue à 0,03 et 0,28 V, correspondant à la réduction et à l'oxydation des ions FeIII/FeII à spin élevé attachés aux atomes de carbone. La deuxième paire de pics redox apparaît à 1,12 et 1,26 V, correspondant à la réduction et à l'oxydation des ions FeIII/FeII bas spin liés aux atomes d'azote. À la même vitesse de balayage,
La figure 4 (b) montre les courbes de charge-décharge à courant constant de HQ-FeHCF et LQ-FeHCF à 1C (1C = 120 mA g-1). On peut clairement voir sur la figure que HQ-FeHCF a deux plateaux de tension pendant le processus de charge et de décharge, indiquant que l'insertion/extraction de Na+ est réalisée en deux étapes. Cela correspond aux deux paires de pics redox apparaissant sur la figure 4(a). Le LQ-FeHCF présente des courbes de charge-décharge similaires à celles du HQ-FeHCF, mais sa capacité de décharge est nettement inférieure à celle du HQ-FeHCF.
La figure 4(c) montre les performances de débit de HQ-FeHCF et de LQ-FeHCF. On peut voir sur la figure que les capacités spécifiques du HQ-FeHCF aux taux 1C, 2C, 5C, 10C, 20C, 30C et 40C sont de 124, 118, 105, 94, 83, 74 et 63 mAh·g-1, respectivement. Il convient de noter que lors du retour à 1C, la capacité est revenue à 124 mAh·g-1, montrant d'excellentes performances de débit. Il y a deux raisons pour lesquelles HQ-FeHCF a une si bonne performance de taux : Premièrement, le matériau HQ-FeHCF synthétisé par la méthode dans cet article a une haute qualité et peu de défauts de vacance, assurant ainsi le transport efficace de Na+. Deuxièmement, la grande structure en canaux du matériau raccourcit le chemin de transport du Na+. De plus, la structure de HQ-FeHCF synthétisée lentement en ajoutant du PVP est très stable, et les cycles de charge-décharge à haut débit ne conduiront pas à l'effondrement structurel de HQ-FeHCF, entraînant une dégradation des performances électrochimiques. Les capacités spécifiques de LQ-FeHCF à 1C, 2C, 5C, 10C, 20C, 30C et 40C sont respectivement de 112, 104, 81, 59, 35, 18 et 7 mAh·g-1. La performance globale en débit est moins bonne que celle du HQ-FeHCF, surtout à des débits élevés, l'écart est particulièrement flagrant. En effet, LQ-FeHCF n'a pas de structure stable et il existe un grand nombre de défauts de lacune [Fe (CN) 6] et d'eau cristalline dans son cristal, qui entravent la désintercalation de Na +, ce qui entraîne la capacité spécifique extrêmement faible de LQ -FeHCF à fort grossissement. surtout à des taux élevés, l'écart est particulièrement évident. En effet, LQ-FeHCF n'a pas de structure stable et il existe un grand nombre de défauts de lacune [Fe (CN) 6] et d'eau cristalline dans son cristal, qui entravent la désintercalation de Na +, ce qui entraîne la capacité spécifique extrêmement faible de LQ -FeHCF à fort grossissement. surtout à des taux élevés, l'écart est particulièrement évident. En effet, LQ-FeHCF n'a pas de structure stable et il existe un grand nombre de défauts de lacune [Fe (CN) 6] et d'eau cristalline dans son cristal, qui entravent la désintercalation de Na +, ce qui entraîne la capacité spécifique extrêmement faible de LQ -FeHCF à fort grossissement.
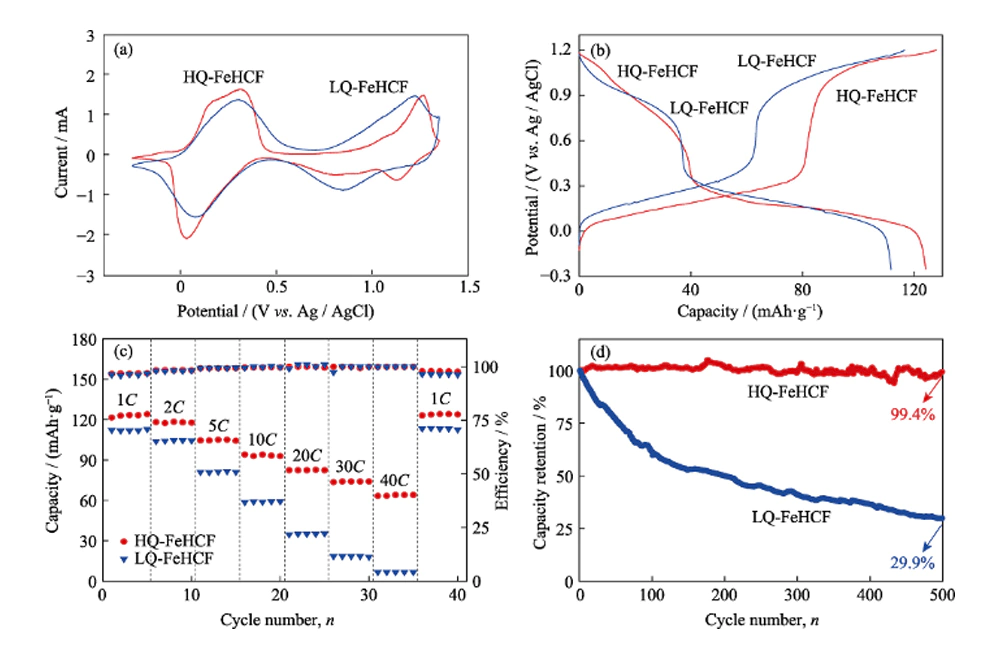
Fig. 4 (a) Courbes de voltammogramme cyclique (CV) de HQ-FeHCF et LQ-FeHCF à la vitesse de balayage de 1 mV·s-1 dans l'électrolyte de Na-H2O-PEG ; (b) Courbes de charge et de décharge de HQ-FeHCF et LQ-FeHCF à 1C ; (c) Taux de performance de HQ-FeHCF et LQ-FeHCF ; (d) Performances de cyclage de HQ-FeHCF et LQ-FeHCF
La stabilité du cycle est un paramètre important pour les batteries aqueuses Na-ion dans les applications pratiques. Les performances de cyclage de HQ-FeHCF et LQ-FeHCF à un taux de 5C sont illustrées à la Fig. 4 (d). La capacité de décharge du LQ-FeHCF dans le premier cycle est de 87 mAh.g-1, mais sa capacité diminue rapidement avec l'augmentation des temps de cycle. Après 100 cycles, le taux de rétention de capacité était de 61 %, et après 500 cycles, la capacité n'était que de 26 mAh.g-1, correspondant à un taux de rétention de capacité de 29,9 %. HQ-FeHCF présente une stabilité de cycle extrêmement excellente. Après 100 cycles, la capacité de HQ-FeHCF n'a pas diminué de manière significative, maintenant un taux de rétention de capacité de 100 %, et le taux de rétention de capacité était toujours aussi élevé que 99,4 % jusqu'au 500e cycle.
Afin de vérifier davantage la stabilité de HQ-FeHCF dans l'électrolyte Na-H2O-PEG, les électrodes après 100 cycles et 500 cycles ont été observées par MEB. Comme le montre la figure 5, la figure 5 (a ~ b) est la photo SEM de HQ-FeHCF dans l'électrolyte Na-H2O-PEG après 100 fois de charge et de décharge à courant constant à 5C. On peut clairement voir sur la figure que chaque particule de nanocube HQ-FeHCF maintient un haut degré d'intégrité, presque aucun dommage structurel et aucun défaut à la surface des particules. La figure 5 (c ~ d) sont des photos SEM de HQ-FeHCF dans l'électrolyte Na-H2O-PEG après 500 charge et décharge à courant constant à 5C. Chaque particule de nanocube HQ-FeHCF maintient également un haut degré d'intégrité sans aucune déformation structurelle ni effondrement. La pièce polaire après 500 cycles a été soumise au test TG, comme le montre la figure 6. La teneur en eau de cristallisation du HQ-FeHCF était de 13 %, aucun changement significatif par rapport à avant le cycle ; la teneur en eau cristalline du LQ-FeHCF était de 20 %, soit une augmentation de 2 % par rapport à avant le cycle.

Fig. 5 Images MEB de HQ-FeHCF après (ab)100 et (cd) 500 cycles
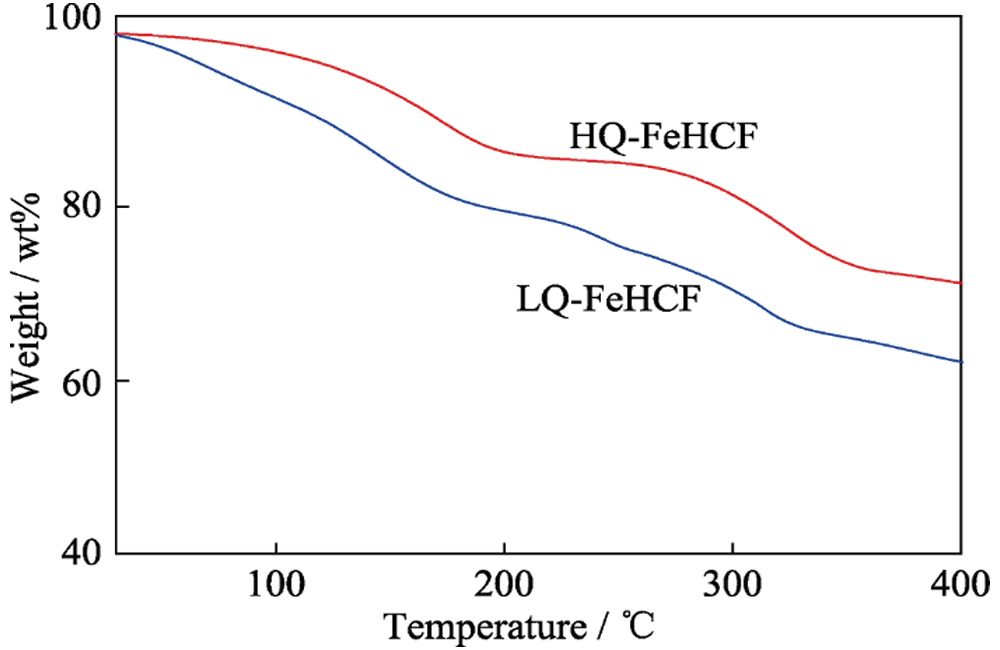
Fig. 6 Courbes TG de HQ-FeHCF et LQ-FeHCF après 500 cycles
Le mécanisme de transition de phase du matériau HQ-FeHCF au cours de la réaction électrochimique a été étudié par technique XRD ex-situ. La figure 7 montre les diagrammes XRD du matériau sous différents états de charge et de décharge, a~e sont le processus de charge, f~i sont le processus de décharge et les points sont marqués avec des pics de diffraction Ti. En prenant le groupe de pics de diffraction dans la boîte en pointillés comme exemple, on peut clairement voir sur la figure que les pics de diffraction XRD se déplacent dans la direction de l'augmentation de 2θ pendant le processus de a~e, de 24,3° à 24,6°. Cela est dû à la contraction du réseau causée par l'extraction de Na+ à partir de HQ-FeHCF pendant le processus de charge. Le changement de volume de la cellule unitaire au cours de ce processus est d'environ 8,1 %. Au cours du processus f ~ i, le pic de diffraction XRD se déplace dans la direction de la diminution de 2θ et revient à 24. 3° encore. En effet, Na + se réintercale dans HQ-FeHCF pendant le processus de décharge, provoquant une expansion du réseau. Il convient de noter que les positions des pics de diffraction a et i coïncident fortement. Cela indique que la désintercalation de Na + dans le matériau HQ-FeHCF est hautement réversible et que la désintercalation réversible de Na + ne détruira pas la structure cristalline du matériau. Il montre également que HQ-FeHCF a une stabilité élevée dans l'électrolyte Na-H2O-PEG.
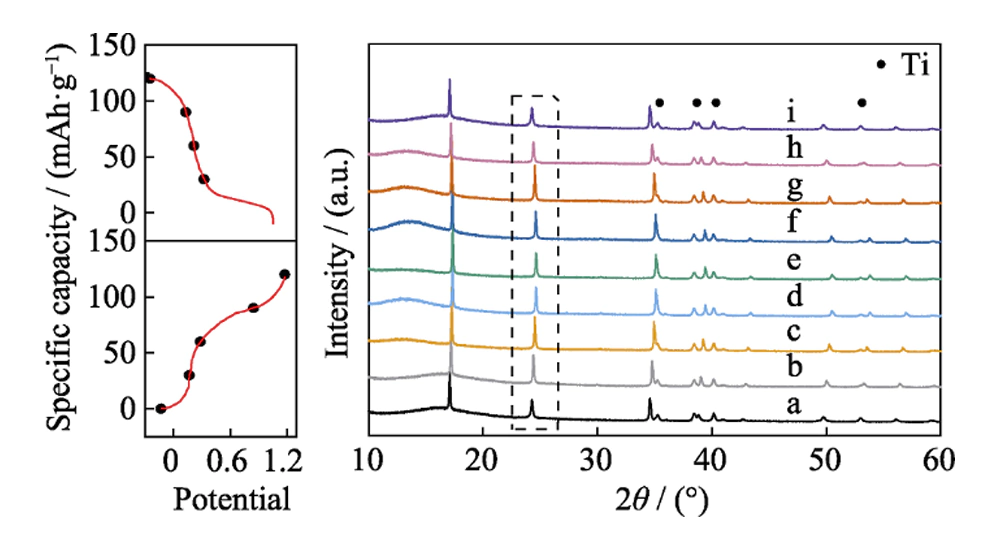
Fig. 7 Modèles XRD ex situ du matériau HQ-FeHCF à différents états de charge et de décharge
Le NaTi2(PO4)3 de type NASICON a une structure tridimensionnelle ouverte adaptée à la diffusion des ions sodium. Par conséquent, le NaTi2(PO4)3 peut être utilisé non seulement comme matériau d'électrode pour les batteries sodium-ion organiques, mais également comme matériau d'électrode pour les batteries sodium-ion aqueuses. NaTi2(PO4)3 a été préparé par une méthode précédente, et ses propriétés électrochimiques dans l'électrolyte Na-H2O-PEG ont été étudiées par voltamétrie cyclique (CV) et charge-décharge galvanostatique. La figure 8 (a) montre la courbe CV de NaTi2(PO4)3 à une vitesse de balayage de 1 mV s-1, avec une paire de pics redox pointus à -0,64 et -0,79 V (vs. Ag/AgCl). Cela correspond à l'intercalation/extraction de Na+, accompagnée de la conversion réversible entre Ti3+ et Ti4+. La distribution de tension de NaTi2(PO4)3 est illustrée à la figure 8(b). La plate-forme à décharge plate à -0,69 V (vs.
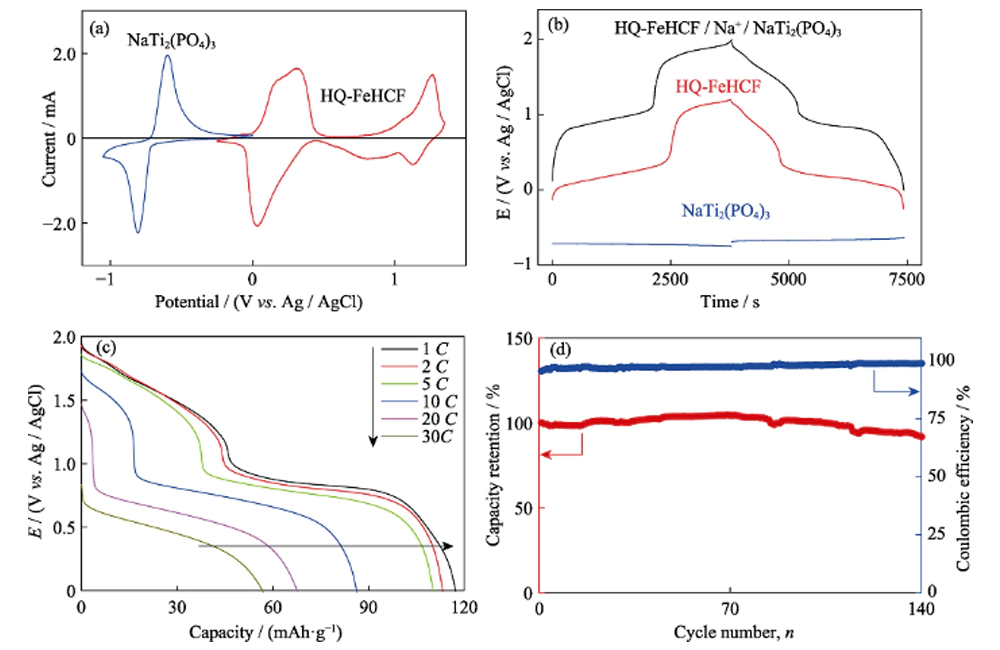
Fig. 8 (a) Courbes de voltammogramme cyclique (CV) de HQ-FeHCF et NaTi2(PO4) à la vitesse de balayage de 1 mV·s-1 dans l'électrolyte de Na-H2O-PEG ; (b) Profils de charge-décharge galvanostatique à 1C pour la cellule pleine, la cathode et l'anode dans l'électrolyte de Na-H2O-PEG ; (c) Performance de débit et (d) performance de cycle de la cellule complète
Bonnes performances électrochimiques basées sur HQ-FeHCF et NaTi2(PO4)3. Nous avons assemblé une batterie complète aqueuse de sodium-ion avec HQ-FeHCF comme électrode positive, NaTi2(PO4)3 comme électrode négative et NaClO4-H2O-PEG comme électrolyte. La figure 8 (b) montre les courbes de tension de l'électrode positive, de l'électrode négative et de la batterie pleine à un taux de 1C. On peut voir sur la figure que la tension de travail de la batterie pleine est aussi élevée que 1,9 V. Une tension de travail élevée est propice à l'amélioration de la densité d'énergie de la batterie pleine, et la densité d'énergie de la batterie pleine calculée sur la base de la la masse de la matière active est aussi élevée que 126 Wh kg-1. Il dépasse la densité d'énergie de la plupart des cellules pleines d'ions Na aqueux précédemment signalées utilisant de l'oxyde de manganèse, du phosphate et du bleu de Prusse comme matériaux de cathode. La comparaison spécifique est illustrée dans le tableau 3. Comme le montre la figure 8(c), au taux de 1C, 2C, 5C, 10C, 20C et 30C, les capacités de la batterie complète sont de 117, 113, 110, 86, 68 et 57 mAh·g-1, respectivement, ce qui montre cette excellente performance de débit. La figure 8(d) montre les performances du cycle de la batterie complète à un taux de 5C. Au cours des 70 premiers cycles, la capacité de la batterie pleine augmente légèrement, et le rendement coulombien augmente progressivement de 96 % au premier cycle à un niveau proche de 100 %. Au cours des 70 cycles suivants, la capacité a commencé à décliner lentement, jusqu'au 140e cycle, le taux de rétention de capacité de la batterie pleine était de 92 %, et le rendement coulombique restait proche de 100 %. Bien que la tension de charge de coupure de la batterie pleine soit aussi élevée que 2 V, dépassant de loin la tension de décomposition théorique de l'eau (1,23 V),
Tableau 3 Densité énergétique de différentes batteries sodium-ion aqueuses
| Cathode |
Anodee |
Densité d'énergie / (Wh·kg-1) |
Réf. |
| Na0.44MnO2 |
NaTi2(PO4)3 |
33 |
[39] |
| Na2Ni[Fe(CN)6] |
NaTi2(PO4)3 |
43 |
[13] |
| Na2Cu[Fe(CN)6] |
NaTi2(PO4)3 |
48 |
[40] |
| NaMnO2 |
NaTi2(PO4)3 |
30 |
[12] |
| K0.27MnO2 |
NaTi2(PO4)3 |
55 |
[41] |
| NaFePO4 |
NaTi2(PO4)3 |
61 |
[42] |
| Na2VTi(PO4)3 |
NaTi2(PO4)3 |
68 |
[43] |
| Na3MnTi(PO4)3 |
NaTi2(PO4)3 |
82 |
[44] |
| Na0.66Mn0.66Ti0.34O2 |
NaTi2(PO4)3 |
76 |
[45] |
| Na2Ni0.4Co0.6[Fe(CN)6] |
NaTi2(PO4)3 |
121 |
[46] |
| Fe4[Fe(CN)6]3 |
NaTi2(PO4)3 |
126 |
Ce travail |
Conclusion
Dans cette étude, des nanomatériaux Fe4[Fe(CN)6]3 de haute qualité et à faible défaut ont été synthétisés avec succès par une méthode hydrothermique simple et pratique. Les résultats du test XRD montrent que le matériau est une structure cubique à faces centrées (fcc), qui appartient au groupe de points d'espace Fm-3m. Les résultats des tests SEM et TEM montrent que le Fe4[Fe(CN)6]3 synthétisé a une excellente cristallinité et que le matériau a une structure cubique typique avec une longueur de côté d'environ 500 nm. La surface du matériau est lisse et uniforme sans accumulation sérieuse. Par rapport au Fe4[Fe(CN)6]3 de faible qualité synthétisé par les méthodes traditionnelles. Le Fe4[Fe(CN)6]3 synthétisé dans cet article peut réduire efficacement les défauts de vacance et réguler l'eau cristalline dans le matériau, de sorte que le matériau présente d'excellentes performances électrochimiques : La capacité spécifique au taux 1C est aussi élevée que 124 mAh·g-1, et la capacité spécifique au taux 2C, 5C, 10C, 20C, 30C et 40C est de 124, 118, 105, 94, 83, 74 et 64 mAh· g-1, respectivement, montrant d'excellentes performances de taux. Après 500 cycles à 5C, le taux de rétention de capacité est proche de 100%, montrant une excellente stabilité de cycle. La tension de fonctionnement de la batterie complète avec Fe4[Fe(CN)6]3 et du phosphate de titane et de sodium comme électrodes positive et négative est aussi élevée que 1,9 V, et la densité d'énergie peut atteindre 126 Wh kg-1. Après 140 fois de charge et de décharge à courant constant à un taux de 5C, le taux de rétention de la pleine capacité de la batterie est de 92 % et l'efficacité coulombique est proche de 100 %. Le Fe4[Fe(CN)6]3 synthétisé par ce procédé pratique et respectueux de l'environnement devrait être utilisé comme matériau de cathode pour les batteries aqueuses aux ions Na.
En savoir plus sur les matériaux des batteries sodium-ion de TOB NEW ENERGY .