Gel double sel de lithium Électrolyte complexe : préparation et application dans une batterie lithium-métaly
GUO Yuxiang, HUANG Liqiang, WANG Gang, WANG Hongzhi. Complexe de gel double sel de lithium Électrolyte : préparation et application dans une batterie lithium-métal. Journal de Matériaux inorganiques, 2023, 38(7) : 785-792 DOI :10.15541/jim20220761
Résumé
Le Li métallique est l'une des anodes idéales pour le lithium-ion à haute densité énergétique batterie en raison de sa capacité spécifique théorique élevée et de son faible potentiel de réduction ainsi que des réserves abondantes. Cependant, l'application des anodes Li souffre de grave incompatibilité avec l'électrolyte liquide organique traditionnel. Ici, un électrolyte complexe en gel (GCE) présentant une compatibilité satisfaisante avec le Li métallique L'anode a été construite par polymérisation in situ. Le doublé Le système de sel de lithium introduit dans l'électrolyte peut coopérer avec le composant polymère, qui élargit la fenêtre électrochimique de l'électrolyte pour 5,26 V contre 3,92 V d'électrolyte commercial, et obtient un niveau ionique élevé conductivité de 1Ã10-3 S·cm-1 à 30 â également. Résultats de caractérisation morphologique et analyse élémentaire de la surface de l'anode Li que le GCE présente un effet protecteur évident sur le lithium métallique sous le état du système à double sel de lithium, effet de volume et croissance des dendrites de l'anode Li sont évidemment inhibées. En même temps, le lithium métal plein batterie, assemblée avec un matériau cathodique commercial au lithium fer phosphate (LiFePO4), présente une excellente stabilité de cyclisme et des performances de taux. La capacité le taux de rétention de la batterie atteint 92,95 % après 200 cycles à une température constante courant de 0,2C (1C = 0,67 mA·cm-2) à 25 â. Cette étude indique que le GCE peut améliorer efficacement la sécurité, la stabilité et l'ensemble des performances électrochimiques de la batterie lithium-métal, qui devraient fournir une stratégie pour la conception universelle d’électrolytes quasi-solides.
Mots clésï¼ Li métallique ; polymérisation in situ ; complexe de gel électrolyte
Depuis que l'objectif « Double Carbone » a été fixé En 2020, la Chine est confrontée à une réforme de son système énergétique sans précédent. Chine doit parvenir à une réduction significative des émissions de carbone au cours des 30 prochaines années, et l'énergie verte se renforcera progressivement jusqu'à remplacer le « monopole » place de l’énergie fossile traditionnelle. En tant que partie importante des énergies renouvelables système énergétique, la technologie des batteries lithium-ion a attiré un large public attention une fois sorti. À l'heure actuelle, en plus d'être la principale source d'énergie Dispositif de produits électroniques 3C, l'application de batteries au lithium dans le les domaines de l'industrie automobile, de l'aérospatiale et des réseaux intelligents se développent progressivement augmentant, ce qui impose des exigences plus élevées en matière de performances. Dans Afin d'obtenir une autonomie de croisière plus longue, les batteries au lithium doivent être alimentées développer un système de batterie avec une densité énergétique plus élevée. Parmi eux, le lithium métal avec une capacité spécifique ultra-élevée (3860 mAh g-1) et un faible potentiel de réduction (-3,04 V (vs SHE)) devrait devenir le matériau d'anode de la prochaine génération de batteries à haute densité énergétique. Cependant, lorsque le lithium métal est en contact avec les électrolytes liquides organiques, des réactions secondaires continuent de se produire au interface, conduisant à une croissance incontrôlable de dendrites de lithium, perçant l'interface séparateur interne de la batterie, provoquant des courts-circuits et même la sécurité problèmes. En réponse à ce défaut, il est habituellement envisagé d'utiliser du solide électrolyte au lieu d'électrolyte liquide pour améliorer la sécurité de la batterie. Cependant, sa faible conductivité ionique à température ambiante et sa mauvaise interface la compatibilité entrave sérieusement son développement et son application ultérieurs.
Dans ce contexte, l'état de gel électrolytes capables d'équilibrer les contacts interfaciaux et la conductivité ionique ont fait l’objet d’une attention croissante. Tan Shuangjie et al. ont développé une électrolyte à l'état de gel ininflammable par immobilisation ignifuge organophosphates dans une matrice polymère de carbonate de polyvinylène à haute résistance mécanique. L'électrolyte présente les avantages d'un taux ionique élevé conductivité et indice de transfert lithium-ion, ininflammabilité, haute résistance mécanique résistance et bonne compatibilité électrochimique. De plus, le gel L'électrolyte formé à l'intérieur de la batterie par polymérisation in situ a le caractéristiques de faible viscosité, de manipulation facile et de forte capacité de mouillage, qui peut infiltrer complètement les matériaux actifs et produire une interface idéale contact, obtenant ainsi un bon chemin de migration des ions. Par exemple, celui de Guo Yuguo Un groupe de recherche a mélangé le monomère traditionnel à base d'éther 1,3-dioxolane (1,3-dioxolane, DOL) avec du 1,2-diméthoxyéthane (1,2-Diméthoxyéthane, DME), du lithium commercial L'hexafluorophosphate (LiPF6), sous forme de sel de lithium, peut déclencher l'ouverture du cycle polymérisation du DOL en même temps, et un nouvel électrolyte à l'état de gel qui peut fonctionner de manière stable dans les batteries lithium-soufre et les batteries cathodiques commerciales a été obtenu. Bien que le polymère à base de polyéther soit l'un des plus stables électrolytes pour anodes métalliques au lithium, sa fenêtre électrochimique étroite et une faible conductivité ionique à température ambiante limite son application à haute énergie batteries de densité. Bien que LiPF6 ait une conductivité ionique idéale et une excellente Compatibilité des électrodes, il présente le problème d'une mauvaise stabilité électrochimique. Par conséquent, pour développer un électrolyte à l’état de gel avec une excellente performances, il est nécessaire de sélectionner des hôtes polymères adaptés, des sels de lithium et d'autres composants.
Pour équilibrer la relation entre conductivité, stabilité haute tension et compatibilité des électrodes, un Le GCE composite solide-liquide haute performance a été développé dans cette étude. Le La méthode de polymérisation in situ initiée thermiquement a été adoptée, le PEGDA a été utilisé comme monomère, un solvant mixte de carbonate d'éthylène et de carbonate de diéthyle a été ajouté, et LiTFSI et LiDFOB ont été introduits en tant que système à double sel de lithium pour travailler avec les composants polymères. Tout en améliorant le performance électrochimique, la stabilité de l'interface entre l'électrolyte et l'anode en lithium métallique est encore améliorée.
1 Méthode expérimentale
1.1 Préparation du GCE
LiTFSI, LiDFOB, EC et DEC (Suzhou Duoduo Chemical Technology Co., Ltd.) sont tous des matériaux de batterie de qualité anhydre. Le Les réactifs EC et DEC ont été mélangés, et LiTFSI et LiDFOB ont été pesés et dissous dans le solvant. L'électrolyte du système à double sel préparé (Liquide L'électrolyte, LE) était une solution EC/DEC (rapport volumique 1 : 1) de 1 mol/L LiTFSI et 0,2 mol/L de LiDFOB. PEGDA (â¥99%, Mn=400) et azobisisobutyronitrile (Azodiisobutyronitrile, AIBN, 98 %) ont été achetés auprès de Shanghai Aladdin Reagent Co., Ltd. La solution précurseur de GCE a été préparée en mélangeant du PEGDA et du LE, et la fraction massique de PEGDA était de 10 %, 20 % et 30 %. Ajouter 1 % de fraction massique de initiateur thermique AIBN et bien mélanger. La solution de précurseur PEGDA a été chauffée à 70° pendant 2 h pour obtenir un gel composite à base de PEGDA entièrement polymérisé électrolytes, nommés GCE-x (x = 10, 20, 30). Les expériences ci-dessus ont été le tout réalisé dans une boîte à gants anhydre et sans oxygène.
1.2 Assemblage de la batterie
Ensemble pile de pile bouton CR2025 (316 acier inoxydable, SS), tôle de lithium (14 mm × 0,45 mm, Li), feuille d'aluminium (qualité de la batterie). Selon différentes exigences de test, les batteries SS||SS, Les batteries Li||SS, Li||Li et Li||LiFePO4 ont été assemblées en la boite à gants. Le rapport massique de LiFePO4, Ketjen Black et Polyvinylidène Le difluorure (PVDF) dans le matériau cathodique est de 90 : 5 : 5, et la capacité surfacique est de 0,67 mAh·cm-2. Voir le matériel supplémentaire S1 pour plus de détails sur la préparation processus de la feuille d'électrode positive et processus d'assemblage de la batterie.
1.3 Méthodes de caractérisation des matériaux
Les groupes fonctionnels et chimiques Les structures des monomères PEGDA et de leurs polymères ont été analysées à l'aide d'un Thermo Spectromètre infrarouge à transformée de Fourier NiColet iS50 (transformée de Fourier Spectromètre infrarouge, FT-IR) de Thermo Fisher Scientific Corporation de la États-Unis, avec une gamme de longueurs d'onde de 400 à 4 000 cm-1. La cristallinité de les électrolytes à l'état de gel avec différentes teneurs en polymères ont été caractérisés par un diffractomètre à rayons X D2 Phaser (diffractomètre à rayons X, XRD) de Bruker AXS Company, Allemagne, et la plage de balayage était de 2θ=5°~80°. Le contact OCA40Micro L'instrument de mesure d'angle de Beijing Dongfang Defei Instrument Co., Ltd. utilisé pour tester l'angle de contact des solutions précurseurs avec différents PEGDA contenu à la surface de la feuille d’électrode LiFePO4. La morphologie microscopique de la section transversale et de la surface de la tôle de lithium a été observée par un Microscope électronique à balayage à émission de champ JElectronics JSM-7500F (champ Microscope Electronique à Balayage d'Emission (FESEM). Les informations élémentaires sur le La surface de la tôle de lithium a été analysée à l'aide d'un appareil à rayons X Escalab 250Xi. spectromètre photoélectronique (spectroscopie photoélectronique à rayons X, XPS) de Thermo Fisher Scientific Corporation des États-Unis.
1.4 Test électrochimique
La fenêtre de stabilité électrochimique du L'électrolyte a été testé par voltammétrie à balayage linéaire (LSV), la plage de tension était de la tension en circuit ouvert (OCV) à 6 V, et le taux de balayage était de 1 mV · s-1. Le la plage de fréquences de la spectroscopie d'impédance électrochimique (EIS) est de 10-2 ~ 106 Hz, et la tension de perturbation est de 10 mV. La chronoampérométrie a été utilisée pour mesurer le nombre de migration des ions lithium dans l'électrolyte, le potentiel la différence était fixée à 10 mV, le temps était de 800 s et le nombre de migration d'ions lithium a été obtenu selon la formule (1) :
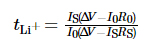
Parmi eux, tLi+ est le numéro de transfert de ions lithium, ÎV est la différence de potentiel, R0 et RS sont l'interface valeurs d'impédance de l'électrode et de l'électrolyte avant et après le test, respectivement, et I0 et IS sont le courant de l'état initial et l'état stable courant, respectivement. Les tests ci-dessus ont tous été réalisés sur le PARSTAT MC Station de travail électrochimique multicanal d'AMETEK, USA. Les performances du cycle de charge-décharge de la batterie a été testée à l'aide de la plate-forme de test de batterie LAND CT3001A-1U de Wuhan Landian Electronics Co., Ltd.
2 Résultats et discussion
2.1 Préparation et analyse structurelle des GCE
Dans cette étude, le PEGDA a été utilisé comme monomère, AIBN a été utilisé comme initiateur de polymérisation, et EC et DEC ont été introduits comme plastifiants. Un électrolyte à l'état de gel avec un polymère réticulé Le diméthacrylate de polyéthylèneglycol (p(PEGDA)) a été synthétisé à 70 °C. Le La formule de la réaction de polymérisation est représentée sur la figure 1 (a). Après avoir ajouté le initiateur thermique AIBN, PEGDA avec deux groupes terminaux actifs C=C rapidement subit une homopolymérisation intermoléculaire lorsqu'il est chauffé à 70 °C. L'actif les chaînes d'AIBN relient les chaînes moléculaires entre elles ou en interne, et enfin obtenir la structure du squelette du réseau p(PEGDA), et réussir utiliser la méthode de polymérisation in situ pour obtenir l'électrolyte à l'état de gel à l'intérieur de la batterie. Comme le montre la figure S1, les trois solutions précurseurs avec différentes teneurs en PEGDA ont toutes montré une bonne mouillabilité sur le positif LiFePO4 feuille d'électrode, qui est la clé pour obtenir un bon contact interfacial entre l'électrolyte et l'électrode.
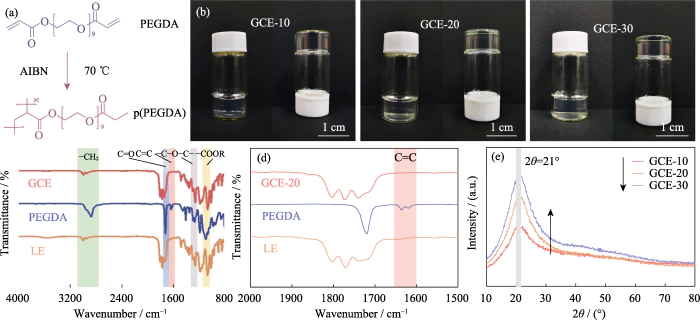
Fig. 1 Préparation et analyse structurelle du GCE
(a) Polymérisation réaction du PEGDA ; (b) Photographies optiques de GCE-x ; (c, d) FT-IR spectres de GCE-20, PEGDA et LE ; (e) Modèles XRD de GCE-x ; Coloré les chiffres sont disponibles sur le site
Afin d'obtenir un GCE à haute teneur ionique conductivité, LiTFSI, qui présente un degré élevé de dissociation dans le polymère, a été utilisé comme sel de lithium et 0,2 mol/L de LiDFOB a été introduit pour construire le réseau de gel du système double sel. LiDFOB a une bonne solubilité et stabilité thermique, notamment dans les propriétés filmogènes. Quand le carbonate les solvants sont en contact avec les anodes métalliques au lithium, un grand nombre de des couches de dépôt de lithium poreuses ou dendritiques sont susceptibles de se former sur le surface du lithium métal. L’introduction de LiDFOB peut aider à formation d'une interphase d'électrolyte solide sans HF (électrolyte solide Interphase, SEI) et améliore la compatibilité avec les anodes lithium métal. En même temps, le LiTFSI a un effet corrosif sur les collecteurs de courant métalliques, tandis que LiDFOB peut passiver l'aluminium métallique et atténuer l'effet de corrosion de LiTFSI sur collecteurs de courant. Cependant, l'électrolyte à sel unique du LiDFOB présentait une impédance plus élevée que l'électrolyte à double sel LiTFSI-LiDFOB du même concentration. Comme le montre la figure S2, la batterie Li||LiFePO4 a été assemblé à l'aide d'électrolytes en gel LiDFOB et LiTFSI-LiDFOB 1,2 mol/L, respectivement, et l'impédance de la batterie LiTFSI-LiDFOB était significativement plus petit.
Les résultats de recherche existants montrent que LiTFSI et LiDFOB peuvent avoir un effet synergique, améliorant efficacement le compatibilité de l'électrolyte avec l'anode lithium métal. Jiao Shuhong et al. utilisé XPS et FT-IR pour découvrir que l'électrolyte à double sel de LiTFSI et LiDFOB peut passiver le collecteur de courant en aluminium de l'électrode positive et forment une couche SEI stable sur la surface du négatif au lithium métallique Électrode pour obtenir un cycle stable à long terme des batteries au lithium métal. Sur sur cette base, Liu Yue et al. [26] ont utilisé la simulation de dynamique moléculaire hybride pour étudier le mécanisme d'action conjoint du LiTFSI et du LiDFOB dans le lithium métal batteries et a expliqué l'effet protecteur du LiTFSI sur le LiDFOB. Études ont montré que la liaison BO du LiDFOB est relativement la plus faible et la plus sujette à rupture. Le LiDFOB se décomposera rapidement sous l'action des radicaux libres et réagir avec le lithium métal pour produire des atomes libres de Li0 et de bore. L'atome de bore La réaction d'insertion amène les molécules de solvant dans l'électrolyte à se décomposer et les fragments moléculaires résultants continueront à réagir avec fragments moléculaires de sel de lithium et atomes de bore. Dans le système au sel de dilithium, cependant, LiTFSI se décompose préférentiellement, en s'appuyant sur le « sacrifice mécanisme" pour protéger le LiDFOB, le taux de décomposition du LiDFOB est considérablement réduit. Réduisant ainsi le nombre d'atomes libres de Li0 et de bore, ce qui peut optimiser la couche SEI et protéger l'anode en lithium métallique.
Comme le montre la figure 1(b), GCE-x est uniforme et transparente, gélatineuse, plus fluide. Pour vérifier davantage le monomère polymérisation, FT-IR a été utilisé pour caractériser les structures chimiques du LE, Monomère PEGDA et GCE-20. Comme le montre la figure 1 (c), les trois échantillons montrent le pic d'absorption typique de la vibration d'étirement C = O (~ 1726 cm-1). Le le pic d'absorption à 1280 cm-1 du GCE correspond au pic antisymétrique et pics d'étirement symétriques de la liaison éther, indiquant que -(CH2CH2)n- dans le monomère n'est pas détruit lors de la polymérisation. Les sommets à 1095 et 2867 cmâ1 appartiennent respectivement à -COOR et -CH2. Comme montré sur la figure 1 (d), le pic caractéristique de la liaison C = C du PEGDA est situé à 1616-1636 cm-1, mais il disparaît dans GCE, indiquant que PEGDA a été complètement polymérisé.
Puisque les ions lithium migrent uniquement dans le région amorphe du GCE, réduisant la cristallinité de l'électrolyte est bénéfique pour améliorer la conductivité ionique. La figure 1 (e) est le modèle XRD de GCE-x. Les trois types d'échantillons ont tous un pic d'absorption de diffraction unique à 2θ=21°, indiquant que l'électrolyte préparé a une région amorphe accompagné d'une petite quantité de cristallites. Comme le contenu de PEGDA augmente, la surface maximale du spectre augmente considérablement, la La proportion de la région amorphe de l'électrolyte en gel diminue et la la teneur en composants amorphes dans l'électrolyte diminue, ce qui n'est pas le cas propice à la migration des ions.
2.2 Performances électrochimiques du GCE et Analyse de compatibilité du métal Li
Afin d'étudier la compatibilité de électrolytes avec différentes teneurs en polymères avec anodes métalliques au lithium dans batteries, les spectres d'impédance des batteries symétriques Li||Li avec GCE-x les électrolytes à l'état initial ont été analysés (comme le montre la figure S3). Dans le figure, les valeurs d'impédance d'interface des batteries GCE-10 et GCE-20 sont tous deux petits, respectivement 93 et 152 Ω, et la batterie GCE-30 atteint 409 Ω. Cela montre que la migration des ions lithium dans les GCE avec une teneur en polymère plus élevée nécessite surmonter une barrière migratoire plus importante, qui ne favorise pas une migration rapide conduction des ions lithium à l'interface.
Observer le surpotentiel du Li||Li batterie symétrique dans le test du cycle de charge-décharge, nous pouvons connaître le potentiel différence générée par la migration des paires d'ions au cours de ce processus, puis évaluer le comportement de dépôt/décapage du lithium. La figure S4 montre le courbes tension-temps de la cellule symétrique Li||Li du GCE-x. La température d'essai était de 25 â, et la batterie était chargée et déchargée sous un courant constant avec une capacité spécifique de 0,5 mAh cm-2 et une densité de courant de 0,5 mA cm-2. La surtension initiale des cellules Li|GCE-10|Li était de 22 mV et la tension augmenté à 137 mV après 250 h. Le surpotentiel du GCE-30 symétrique la batterie était de 104 mV au stade initial, et la surtension a augmenté rapidement dans les cycles suivants, atteignant une valeur maximale de 509 mV en 227 h, puis a chuté brusquement, indiquant que la batterie présentait un court-circuit interne. Dans En revanche, la batterie GCE-20 peut fonctionner à un faible surpotentiel proche de 30 mV, et a les performances électrochimiques les plus stables. Ce qui suit se concentrera sur l'électrolyte GCE-20.
La conductivité ionique d'un électrolyte reflète directement la capacité des ions à migrer dans un champ électrique. Le la conductivité ionique du LE et du GCE-20 a été testée à 60, 50, 40, 30, 20, 10 et 0 â, respectivement. Comme le montre la figure 2 (a), la conductivité ionique du GCE-20 à 30 °C équivaut à 1,00 mS cm-1, et lorsque la température d'essai monte à 60 °C, la la conductivité atteint 1,39 mS cm-1. C'est parce que l'énergie d'activation diminue avec l'augmentation de la température d'essai et l'activité de mouvement de les segments de chaîne polymère et les ions lithium augmentent. Cependant, la vitesse de déplacement des segments de chaîne polymère est évidemment affecté par la température, donc le la conductivité de l'électrolyte en gel GCE-20 change plus que celle de l'électrolyte solution.
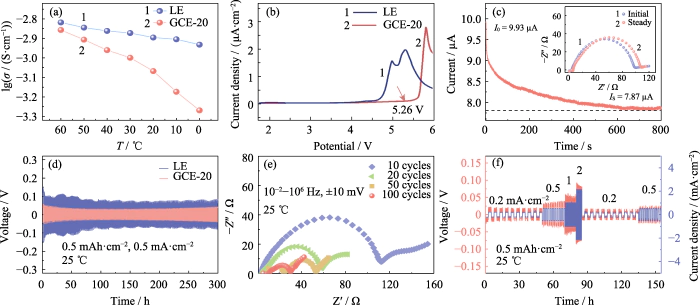
Fig. 2 Performances électrochimiques du GCE-20
(a) Ionique conductivités de LE et GCE-20 ; (b) Courbes LSV de LE et GCE-20 ; (c) Profil temporel actuel de la cellule Li|GCE-20|Li avec encadré montrant le Parcelles de Nyquist ; (d) Courbes tension-temps de cellules Li||Li symétriques assemblées avec LE et GCE-20 ; (e) tracés de Nyquist de cellule Li | GCE-20 | Li après cyclage ; f) Courbes tension-temps et densité de courant-temps de la cellule Li|GCE-20|Li ; Coloré les chiffres sont disponibles sur le site
Améliorer la densité énergétique des batteries nécessite d'assurer la stabilité de l'électrolyte à des tensions de fonctionnement élevées. Des études ont montré que les électrolytes à base de polymères carbonylés sont généralement avoir une large fenêtre électrochimique et une bonne stabilité à des températures de fonctionnement élevées tensions. La figure 2 (b) montre que la courbe LSV de la batterie GCE-20 commence à fluctue significativement à 5,26 V, et on peut considérer que la La fenêtre électrochimique de l'électrolyte gel GCE-20 atteint 5,26 V. Dans En revanche, la fenêtre électrochimique de l'électrolyte commercial n'est que de 3,92 V. Par conséquent, l’électrolyte à l’état de gel présente une excellente stabilité électrochimique à haute tension.
De plus, la migration des ions lithium Le nombre de l'électrolyte est également l'un des indicateurs pour mesurer le lithium conductivité ionique. Il est défini comme le rapport du nombre d'ions lithium traversant une section de l'électrolyte perpendiculaire à la direction de migration des ions lithium par unité de temps jusqu'à la somme des anions et des cations passant à travers la section. Plus la valeur est élevée, plus la proportion de lithium est importante ions dans le processus de migration des ions, et plus l'efficacité de la migration est élevée. La figure 2 (c) est la courbe chronoampérométrie de la batterie Li | GCE-20 | Li, où l'encadré est la comparaison de l'impédance électrochimique de la batterie avant et après l'examen. D'après la formule (1), l'indice de migration des ions lithium du GCE-20 est de 0,21. L'introduction d'additifs ou le dopage avec des substances inorganiques Les charges peuvent obtenir un taux de migration des ions lithium plus élevé, ce qui n'est pas seulement bénéfique pour améliorer le taux de charge et de décharge de la batterie, mais aussi améliorer sa stabilité de cycle.
Pendant le processus de charge et de décharge de batterie symétrique Li||Li, les anions et les cations dans l'électrolyte subissent contre-migration. Lors de la charge, les ions lithium migrent vers le négatif l'électrode, et les anions migrent vers l'électrode positive, et l'inverse est vrai lors de la décharge. Par conséquent, pendant le processus de charge et de décharge, le gradient de concentration ionique entre les électrodes positives et négatives et le champ électrique intégré augmente progressivement, empêchant le mouvement inverse d'anions et de cations, entraînant une polarisation de concentration à l'intérieur du batterie, entraînant un changement de surpotentiel. Comme le montre la figure 2(d), le La batterie Li|GCE-20|Li présente un surpotentiel de 46 mV après un cycle stable de 300 h. Cependant, la surtension générée par la batterie Li|LE|Li lors du test est nettement supérieure à celle de la batterie Li|GCE-20|Li (65~118 mV). Ce C'est parce que les dendrites de lithium en croissance provoquent des courts-circuits légers à certains endroits. sites internes. Les résultats montrent que le comportement électrochimique à l'intérieur du La batterie GCE-20 est plus idéale. La figure 2 (e) est le test EIS du système symétrique batterie après 10, 20, 50 et 100 cycles. Comme le nombre de charge-décharge cycles augmente, l’impédance de la batterie a tendance à diminuer. Au cours de ce processus, une couche SEI stable a été construite entre l'électrolyte et le lithium métallique Interface, et le contact d'interface a été optimisé, de sorte que l'interface l'impédance a diminué de manière significative.
À 25 °C, la batterie Li|GCE-20|Li était soumis à 10 cycles de charge-décharge à des densités de courant de 0,2, 0,5, 1, 2, 0,2 et 0,5 mA cm-2, respectivement. La figure 2(f) reflète la tendance du surtension de la cellule symétrique au fil du temps au cours de ce processus. Le la surtension à faible densité de courant est faible et peut rester relativement stable. Une fois que la densité de courant augmente, la surtension augmente en conséquence, et il n'y a pas d'augmentation/diminution soudaine de la tension pendant le processus.
La morphologie du revêtement en feuille de lithium après le cyclage peut caractériser visuellement le comportement de dépôt/décapage de lithium à l'intérieur de la batterie. La batterie symétrique Li||Li a été démontée après charge et décharge pendant 100 h à une capacité de 0,5 mAh cm-2 et un courant densité de 0,5 mA cm-2, et la morphologie microscopique de la section transversale et La surface de la tôle de lithium a été observée par FESEM. Comme le montre la figure 3(a, b), l'épaisseur de la feuille de lithium vierge non traitée est de 353 µm, et la surface est plate et lisse. L'interaction entre l'électrolyte liquide et le lithium métallique conduit au dépôt d'un grand nombre de particules lâches et poreuses couches de dépôt de lithium sur la surface de la feuille de lithium du Li|LE|Li batterie, le plus souvent sous forme de mousse fine et inégale. Lorsque l'épaisseur du la tôle de lithium augmente à 446 µm, il y a une expansion de volume évidente effet, et un grand nombre de dendrites sont générés. En revanche, le l'épaisseur de la feuille de lithium dans la batterie Li|GCE-20|Li est de 391 μm, et le la couche de dépôt superficielle est dense et uniforme, et il n'y a pas de finement divisée revêtement au lithium (Fig. 3 (c)). Cela montre que l'électrolyte à l'état de gel peut supprime efficacement l'expansion du volume de l'anode au lithium métallique. LiDFOB dans GCE-20 peut aider à la formation d'une couche SEI stable pour équilibrer le système interne potentiel de la batterie, et retarder la croissance des dendrites de lithium en induisant dépôt uniforme de lithium. Ainsi, dans une certaine mesure, il peut optimiser le comportement de dépôt/décapage du lithium et protège l'anode au lithium métallique.

Fig. 3 Images MEB de Li métallique
Transversal (haut) et images SEM en vue de dessus (vers le bas) de (a) dépôts frais de Li et de lithium métalliques morphologie dans les cellules symétriques Li||Li avec (b) LE et (c) GCE-20
Par la suite, analyse des éléments de surface XPS a été utilisé pour explorer la composition de la couche SEI à la surface du anode lithium métal sous l'action du système double sel LiTFSI-LiDFOB GCE. La figure S5 est le spectre XPS de la surface de l'anode au lithium métallique utilisant LE et GCE-20. Le spectre des C1 (Fig. S5 (a, d)) comporte principalement 4 pics de signal, correspondant à C-C/C-H à 284,8 eV. Les deux pics à 286,4 et 289,4 eV correspondent respectivement à C-O et C=O, et ils sont principalement dérivés du produits de décomposition des solvants carbonatés (tels que ROCO2-, ROC-, etc.). Le le pic à 292,7 eV correspond à CF3, qui est principalement dérivé du produits de décomposition des sels de lithium. Dans le spectre O1s (Figure S5 (b, e)), les pics à 531,1 et 532,3 eV correspondent respectivement à C=O et C-O, et la teneur relative en C-O est considérablement réduite, ce qui est principalement lié à la diminution de la teneur en produits de décomposition. Sous l'articulation action de LiTFSI et LiDFOB, la formation de LiOCH3, Li2O2C2H4 et autres les sous-produits sont restreints. En plusition, contrairement au LE (Fig. S5 (e)), dans les F1 spectre de GCE-20 (Fig. S5 (f)), le pic du signal de LiF est à 684,5 eV et LiF peut aider à la formation d’une couche SEI dense et stable.
2.3 Analyse des performances électrochimiques de Batterie Li||LiFePO4
LiFePO4 présente les avantages d'une haute capacité, longue durée de vie et sécurité exceptionnelle, et constitue un point positif majeur matière active d'électrode. Sa capacité spécifique théorique est de 170 mAh·g-1. À 25 â, la batterie Li|GCE-20|LiFePO4 a été chargée et déchargée 200 fois à une courant constant de 0,2C (1C=0,67 mA·cm-2). Comme le montre la figure 4(a, b), le La capacité spécifique de décharge du premier cycle est de 141,4 mAh·g-1. La décharge la capacité spécifique du 200ème tour est de 131,4 mAh·g-1, la capacité de rétention le taux atteint 92,95 % et la décroissance de la capacité sur un seul tour est inférieure à 0,04 %. Le la tension de la plate-forme est stable, conforme aux caractéristiques du LiFePO4 piles. Efficacité coulombienne, comme indicateur important pour évaluer la batterie la stabilité du cycle, fait référence au rapport entre la capacité de décharge de la batterie et la charge capacité au cours du même cycle. L'efficacité coulombienne du premier cycle du La batterie Li|GCE-20|LiFePO4 est à 97,8 %. En raison de la formation de la couche SEI pendant le processus de décharge du premier cycle, une partie de la capacité irréversible est généré, ce qui entraîne une faible efficacité coulombienne du premier cycle.
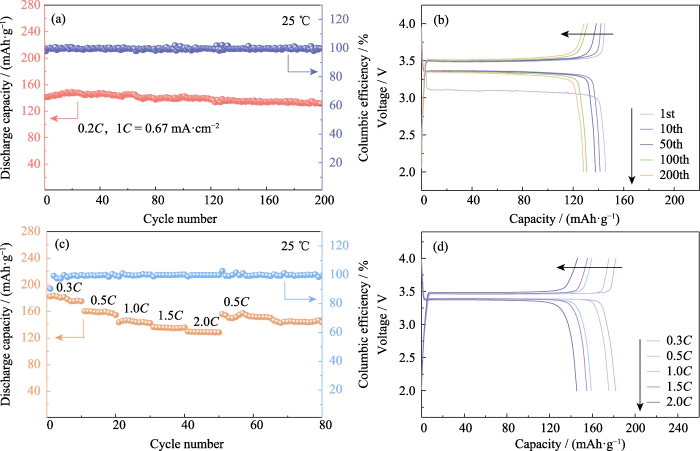
Fig. 4 Performance électrochimique du Cellules Li|GCE-20|LiFePO4
(a) Cyclisme performances et (b) les courbes tension-capacité correspondantes à 0,2C ; (c) Performance de débit et (d) courbes tension-capacité correspondantes ; Coloré les chiffres sont disponibles sur le site
De plus, des tests de charge et de décharge ont été réalisées sur Li|GCE-20|LiFePO4 à des taux de 0,3C, 0,5C, 1C, 1,5C et 0,5C courants pour explorer ses performances tarifaires. Comme le montre la figure 4 (c), lorsque le Le taux actuel est de 0,5 °C, la capacité spécifique de décharge du premier cycle du la batterie est de 160,2 mAh·g-1. À mesure que le taux actuel augmente, le débit spécifique la capacité de la batterie diminue dans une plage contrôlable. Le taux est augmentée à 2C, et la capacité spécifique du premier cycle dla charge est de 130 mAh·g-1. Par la suite, le taux actuel est revenu à nouveau à 0,5°C, et le La capacité spécifique de la décharge du premier cycle était de 156,1 mAh·g-1. Le pertinent les courbes tension-capacité sont présentées à la figure 4 (d). La tension de plateau à différents taux est stable sans provoquer une augmentation du surpotentiel, et le la batterie présente de bonnes performances de débit et une bonne réversibilité.
3 Conclusion
Le GCE à base de PEGDA a été développé par initier la polymérisation in situ. L’analyse de caractérisation FT-IR et XRD du GCE, combiné à des tests électrochimiques, a sélectionné le GCE optimal formulation. Assemblez davantage la batterie pour étudier le comportement électrochimique performances de l'électrolyte et analyser l'effet protecteur du électrolyte sur l'électrode négative au lithium métallique en observant le morphologie microscopique et caractérisation des éléments de surface du lithium métal, expliquant :
1) Le GCE-x (x=10, 20, 30) préparé par La polymérisation in situ peut bien mouiller la feuille d'électrode et l'électrolyte présente la meilleure stabilité électrochimique lorsque la fraction massique de PEGDA est de 20 %.
2) Le système sel de dilithium de LiTFSI et LiDFOB est introduit, ce qui peut former une bonne interaction avec le polymère composants. L'électrolyte possède une large fenêtre électrochimique (5,26 V) et une haute conductivité ionique (30 â, 1Ã10-3 S·cm-1). En même temps, le sel de dilithium Le système peut être utilisé pour construire une couche SEI stable et protéger efficacement le anode au lithium métallique.
3) Utilisation du GCE-20 pour correspondre au message commercial Matériau cathodique LiFePO4, la batterie complète assemblée peut charger et décharge pendant 200 cycles à un courant de 0,2C, avec un taux de rétention de capacité de 92,95 % et présente de bonnes performances en termes de taux.
En résumé, ce travail a obtenu une sécurité et excellentes performances électrochimiques du GCE, qui fournit un solution pour le développement de lithium à haute densité énergétique sûr et stable piles métalliques.
Matériel supplémentaire :
Processus de préparation de la batterie S1
Mélanger et broyer LiFePO4, Ketjen Black et PVDF selon le ratio cible, ajouter le solvant N-Méthylpyrrolidone (N-méthylpyrrolidone, NMP), remuer et disperser complètement, et obtenir un mélange uniforme et suspension de matière active visqueuse. La boue a été grattée sur l'aluminium filmer avec une couche plate, puis transféré dans une étuve sous vide et séché à 80 °C pendant 12h. Après avoir coupé la feuille d'électrode, séchez-la à nouveau et transférez-la dans un boîte à gants anhydre et sans oxygène.
Un joint, des éclats d'obus et une feuille de métal au lithium ont été placés au centre du boîtier de l'électrode négative en séquence, et les l'épaisseur de la tôle de lithium était de 0,35 mm. Par la suite, le précurseur une solution de GCE a été ajoutée goutte à goutte au centre de la surface du négatif électrode (50 µL) à l'aide d'un pistolet pipette, puis de la batterie Celgard 2500 séparateur et la feuille d'électrode positive (séparateur de batterie Celgard 2500) ont été placés en séquence. Avant d'assembler la batterie Li||LiFePO4, le la pièce polaire positive a été pesée et la charge de matière active a été enregistrée. La charge superficielle du matériau actif de l'électrode positive LiFePO4 était de 3,94. mg cm-2. Enfin, mettez sous pression et scellez la batterie sur une machine à sceller la batterie, transférez-le dans un environnement à 70 °C et chauffez-le pendant 2 h pour initier polymérisation pour obtenir un électrolyte à l'état de gel. Afin de garantir que le l'électrolyte infiltre entièrement la pièce polaire LiFePO4, la batterie doit être laissé reposer 1 h après assemblage.
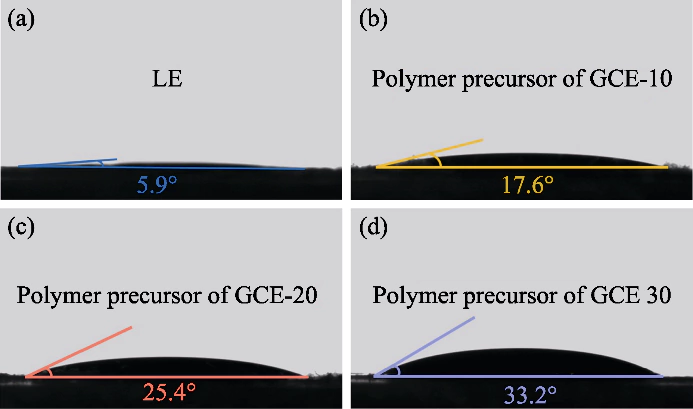
Fig. S1 Angles de contact entre la solution de précurseur de polymère et les cathodes
(a) LE ; (b) CME-10 ; (c) CME-20 ; (d) GCE-30
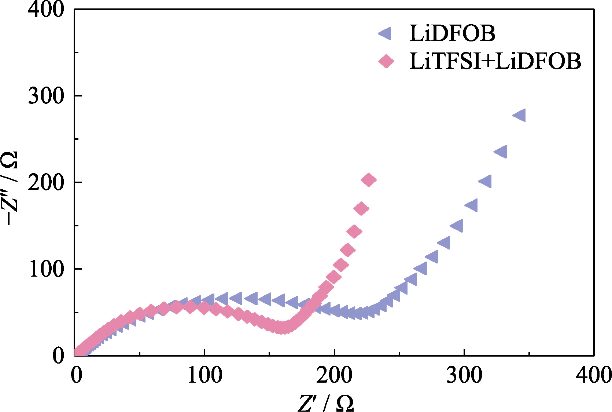
Fig. S2 Tracés de Nyquist de cellules Li||LiFePO4 assemblées par GCE avec différents sels de lithium
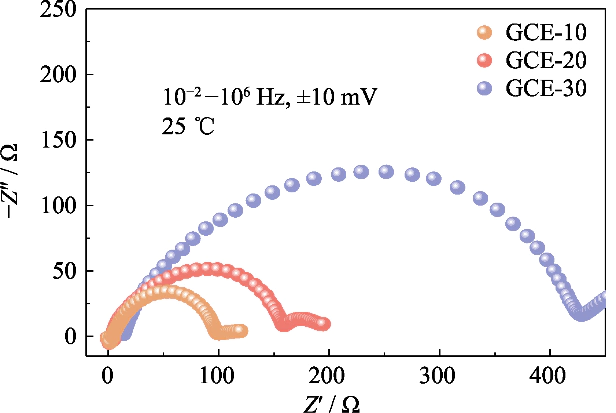
Fig. S3 Nyquist tracés de cellules Li||Li symétriques assemblées avec des électrolytes GCE-x
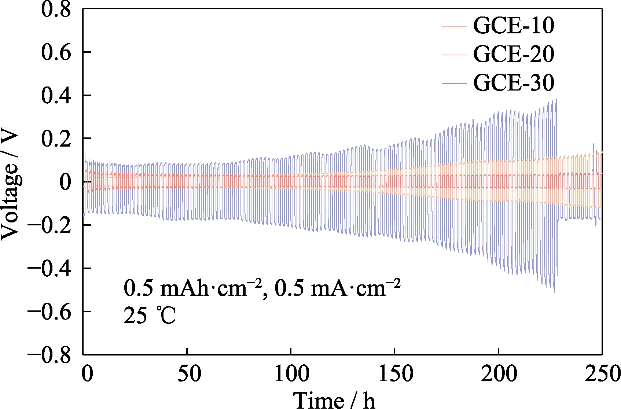
Fig. S4 Profils tension-temps de cellules Li||Li symétriques assemblées avec des électrolytes GCE-x
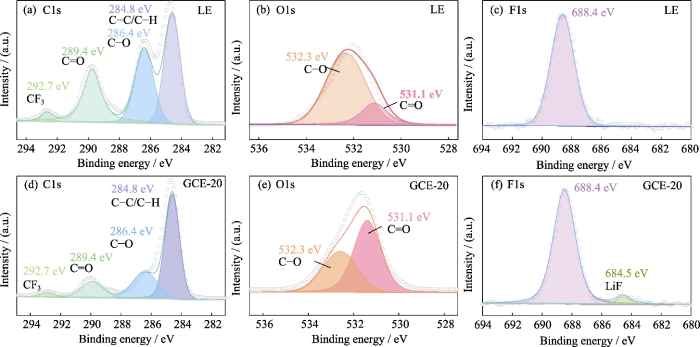
Fig. S5 XSpectres PS d'anode métallique Li dans des cellules Li||Li symétriques
(a, d) C1s, (b, e) O1s, (c, f) F1s Spectres XPS d'anode métallique en Li avec (a-c) LE et (d-f) GCE-20
[1] BON ASSEZ J B, KIM Y.
Les défis pour piles Li rechargeables
Chimie de Matériaux, 2010, 22(3):587.
[2] ZHAO J, LIAO L, SHI F, et al.
Fluoration de surface de matériaux d'anode de batterie réactifs pour une stabilité améliorée
Journal du American Chemical Society, 2017, 139(33):11550.
[3] TARASCON J. M, ARMAND M.
Problèmes et défis face aux piles rechargeables au lithium
Nature, 2001, 414(6861):359.
[4] ZHI J, YAZDI A Z, VALAPPIL G, et al.
Solide artificiel interphase électrolytique pour systèmes de stockage d'énergie aqueux au lithium
Science Advances, 2017, 3(9):e1701010.
[5] JUN K, SUN Y, XIAO Y, et al.
Lithium superionique conducteurs avec ossatures de partage d'angle
Matériaux naturels, 2022, 21 : 924.
[6] LIU J, BAO Z, CUI Y, et al.
Voies pour batteries lithium-métal pratiques à haute énergie et à cycle long
Énergie naturelle, 2019, 4(3):180.
[7] DUNN B, KAMATH H, TARASCON J M.
Énergie électrique stockage pour le réseau : une batterie de choix
Science, 2011, 334(6058):928.
[8] MAUGER A, JULIEN C M, PAOLELLA A, et al.
Construire mieux batteries à l'état solide : un avis
Matériaux, 2019, 12(23):3892.
[9] MANTHIRAM A, YU X, WANG S.
Batterie au lithium produits chimiques activés par les électrolytes à l'état solide
Avis sur la nature Matériaux, 2017, 2(4):16103.
[10] ZHOU D, SHANMUKARAJ D, TKACHEVA A, et al.
Électrolytes polymères pour les batteries au lithium : avancées et perspectives
Chem, 2019, 5(9):2326.
[11] TAN S J, YUE J, TIAN Y F, et al.
Encapsulation in situ du phosphate ignifuge dans une matrice polymère robuste pour des batteries au lithium métal quasi-solides sûres et stables
Stockage d'énergie Matériaux, 2021, 39 : 186.
[12] ZHAO Q, LIU X, STALINE S, et al.
Polymère à l'état solide électrolytes avec transport interfacial rapide intégré pour le lithium secondaire piles
Énergie naturelle, 2019, 4(5):365.
[13] ZHOU Z, FENG Y, WANG J, et al.
Un robuste, hautement peau extensible conductrice d'ions pour batteries stables au lithium métal
Génie chimique Journal, 2020, 396 : 125254.
[14] WILKEN S, TRESKOW M, SCHEERS J, et al.
Étapes initiales de décomposition thermique des électrolytes de batterie lithium-ion à base de LiPF6 par Raman et RMN détaillées spectroscopie
RSC Advances, 2013, 3(37):16359.
[15] LIU F Q, WANG WP, YIN Y X, et al.
Mise à niveau traditionnelle électrolyte liquide via gélification in situ pour le futur lithium piles métalliques
Science Advances, 2018, 4(10):eaat5383.
[16] XU C, SUN B, GUSTAFSSON T, et al.
Couche d'interface formation dans les batteries au lithium à électrolyte polymère solide : une étude XPS
Journal des matériaux Chimie A, 2014, 2(20):7256.
[17] WEI Z, CHEN S, WANG J, et al.
Lithium-ion supérieur conduction d'un électrolyte polymère avec une structure en forme de peigne via sans solvant copolymérisation pour batterie bipolaire au lithium tout solide
Journal des matériaux Chimie A, 2018, 6(27):13438.
[18] DI NOTO V, LAVINA S, GIFFIN GA, et al.
Électrolytes polymères : présent, passé et futur
Electrochimica Acta, 2011, 57(15):4.
[19] XUE Z, HE D, XIE X.
Poly(éthylène électrolytes à base d'oxyde) pour batteries lithium-ion
Journal des matériaux Chimie A, 2015, 3(38):19218.
[20] MINDEMARK J, LACEY M J, BOWDEN T, et coll.
Au-delà Matériaux hôtes alternatifs PEO pour électrolytes polymères solides conducteurs Li+
Progrès en polymère Sciences, 2018, 81 : 114.
[21] ARAVINDAN V, GNANARAJ J, MADHAVI S, et al.
Lithium-ion sels d'électrolyte conducteurs pour batteries au lithium
Chemistry-A European Journal, 2011, 17(51):14326.
[22] XU K.
Électrolytes et interphases dans les batteries Li-ion et au-delà
Chemical Reviews, 2014, 114(23):11503.
[23] YANG H, ZHUANG G V, ROSS JR P N.
Stabilité thermique de Batterie LiPF6 au sel et Li-ion électrolytes contenant LiPF6
Journal du pouvoir Sources, 2006, 161(1):573.
[24] LI Q, LIU G, CHENG H, et al.
Basse température conception d'électrolytes pour batteries lithium-ion : perspectives et défis
Chimie-A européenne Journal, 2021, 27(64):15842.
[25] JIAO S, REN X, CAO R, et al.
Cycle stable de batteries au lithium métal haute tension dans des électrolytes éther
Énergie naturelle, 2018, 3(9):739.
[26] LIU Y, YU P, SUN Q, et al.
Opération prévue polymérisation à l'anode de lithium via insertion de bore
Lettres énergétiques d'ACS, 2021, 6(6):2320.
[27] CAO W, LU J, ZHOU K, et al.
Organique-inorganique SEI composite pour une anode métallique Li stable par polymérisation in-situ
Nano énergie, 2022, 95 : 106983.
[28] CHENG S, SMITH D M, LI C Y.
Comment l'échelle nanométrique La structure cristalline affecte-t-elle le transport des ions dans les électrolytes polymères solides ?
Macromolécules, 2014, 47(12):3978.
[29] JOHANSSON P.
Premiers principes modélisation d'électrolytes polymères amorphes : complexes Li+-PEO, Li+-PEI et Li+-PES
Polymère, 2001, 42(9):4367.
[30] SUN B, MINDEMARK J, EDSTRÖM K, et al.
À base de polycarbonate électrolytes polymères solides pour batteries Li-ion
Solid State Ionics, 2014, 262 : 738.
[31] SILVA M M, BARROS S C, SMITH M J, et al.
Caractérisation de électrolytes polymères solides à base de poly(triméthylènecarbonate) et de lithium tétrafluoroborate
Electrochimica Acta, 2004, 49(12) : 1887.
[32] BARBOSA P, RODRIGUES L, SILVA M Métal.
Caractérisation de Électrolytes polymères solides pTMCnLiPF6
Solid State Ionics, 2011, 193(1):39.