Cadre en carbone creux dopé au cobalt comme hôte de soufre pour la cathode de la batterie au lithium-soufre
Auteurs : JIN Gaoyao, HE Haichuan, WU Jie, ZHANG Mengyuan, LI Yajuan, LIU Younian. Cadre en carbone creux dopé au cobalt comme hôte de soufre pour la cathode de la batterie au lithium-soufre. Journal des matériaux inorganiques[J], 2021, 36(2): 203-209 DOI:10.15541/jim20200161
TOB New Energy fournit divers matériaux de batterie pour la batterie au lithium-ion , sodium -ion, la batterie au lithium-soufre, la batterie à semi-conducteurs, la pile à combustible , etc. Contactez-nous pour un devis.
Bien que les performances de la cathode puissent être améliorées dans une certaine mesure avec la synergie des hétéroatomes et de la charpente carbonée, elles sont encore considérablement limitées par la cinétique lente de la réaction de conversion du polysulfure, qui provoque l'accumulation excessive de LiPS et la diffusion inévitable. Des composés de métaux de transition ont été largement introduits dans l'hôte soufré pour accélérer la cinétique de la réaction de conversion. Ces dernières années, des nanoparticules métalliques spécifiques, telles que Co, Fe et Pt, ont montré un effet accélérateur similaire. Parmi ces métaux, le cobalt métallique a attiré l'attention des chercheurs pour son excellente conductivité et sa forte interaction avec les polysulfures. Pendant le processus de charge et de décharge, il peut capturer efficacement les polysulfures et favoriser la réaction de conversion. Li, et al. obtenu le carbone dopé Co et N comme hôte soufré par la calcination du précurseur ZIF-67. Les nanoparticules de Co uniformément dispersées ont nettement accéléré la réaction redox avec l'effet synergique des groupes dopés N. De plus, Du et al. ont présenté la cathode de graphène dopée à l'azote incorporée dans des atomes de cobalt monodispersés, et Wu, et al. ont fabriqué des nanopoints de Co/carbone mésoporeux dopé à l'N avec la calcination in situ de l'adénine et du CoCl2. Dans tous ces rapports, les systèmes co-contenus ont obtenu d'excellentes performances de cyclage. nanopoints de Co fabriqués/carbone mésoporeux dopé N avec la calcination in-situ d'adénine et de CoCl2. Dans tous ces rapports, les systèmes co-contenus ont obtenu d'excellentes performances de cyclage. nanopoints de Co fabriqués/carbone mésoporeux dopé N avec la calcination in-situ d'adénine et de CoCl2. Dans tous ces rapports, les systèmes co-contenus ont obtenu d'excellentes performances de cyclage.
Dans ce travail, pour améliorer les performances cycliques et de vitesse des batteries Li-S, un cadre en carbone creux 3D décoré de nanoparticules de cobalt a été conçu comme hôte de la cathode de soufre. Le citrate de sodium, un additif bon marché et abondant, est utilisé comme source de carbone pour son caractère unique lors de la calcination directe. Et les performances électrochimiques du système contenant du cobalt (Co/C-700) et de la charpente en carbone (HEC-700) ont été systématiquement évaluées pour garantir l'effet des nanoparticules de cobalt dopées pour la cathode de soufre.
1 Expérimental
1.1 Synthèse des matériaux
Tous les réactifs chimiques utilisés dans ce travail étaient de qualité analytique sans autre purification. En bref, 0,25 g de Co(NO3)2·6H2O et 5,0 g de citrate de sodium ont été dissous dans 20 ml d'eau déminéralisée sous agitation magnétique pour former une solution homogène. Ensuite, la solution a été lyophilisée, broyée en poudre fine et calcinée à 700 ℃ sous N2 pendant 1 h avec une vitesse de chauffage de 5 ℃∙min-1. Les composites obtenus (nommés UWC-700) ont été lavés à l'eau déminéralisée 3 fois afin d'éliminer les sous-produits. Après avoir été séché à 60 ℃ pendant une nuit, le produit final a été collecté et désigné par Co/C-700. Pour confirmer davantage l'effet de Co, du carbone gravé à l'acide chlorhydrique (HEC-700) a été obtenu en gravant Co/C-700 dans 2 mol/L HCl pendant 12 h, en lavant jusqu'à neutralité et en séchant à 80 ℃ pendant 12 h.
Les composites cathodiques ont été préparés via une méthode classique de fusion-diffusion. En bref, un mélange de soufre (70% en poids) et de composites Co/C-700 (ou HEC-700) a été broyé pendant 20 min, transféré dans un autoclave en téflon de 20 ml et chauffé à 155 ℃ pendant 12 h. La poudre obtenue a été collectée sous forme de S@Co/C-700 et S@HEC-700. La caractérisation des matériaux et l'adsorption statique des polysulfures sont présentées dans les matériaux de support.
1.2 Caractérisation électrochimique
Les performances électrochimiques des cathodes S@Co/C-700 et S@HEC-700 ont été testées par des piles boutons de type CR2025, fabriquées dans une boîte à gants remplie d'argon (MBraun, Allemagne). La bouillie de cathode de soufre a été préparée en mélangeant S@Co/C-700 (ou S@HEC-700), du noir d'acétylène et un liant de difluorure de polyvinylidène (PVDF) avec un rapport pondéral de 7:2:1 dans du N-méthyl-2- pyrrolidinone (NMP). Ensuite, la bouillie obtenue a été uniformément coulée sur une feuille d'aluminium. De plus, la membrane a été séchée à 50°C sous vide pendant une nuit et découpée en disques (1 cm de diamètre) avec une charge en soufre de 1,1-1,7 mg∙cm-2. La membrane de polypropylène de routine (Celgard 2400) a été utilisée pour séparer la cathode et l'anode de lithium. L'électrolyte utilisé dans chaque cellule était une solution de 50 μL 1mol/L LiN(CF3SO2)2 et 1% en poids de LiNO3 dans DOL/DME (1:1 en volume). Des tests de charge-décharge galvanostatique ont été effectués par un système de test de batterie LAND CT 2001A (Jinnuo Electronic Co, Wuhan, Chine) dans la fenêtre de tension de 1,7 à 2,8 V. La mesure de voltamétrie cyclique (CV) a été effectuée de 1,5 à 3,0 V à une vitesse de balayage de 0,1 mV∙s-1. La spectroscopie d'impédance électrochimique (EIS) a été réalisée dans la gamme de fréquences de 0,1 MHz à 10 mHz avec une amplitude de tension de 5 mV en circuit ouvert. Les mesures CV et EIS ont été effectuées sur une station de travail électrochimique CHI 660E (Chenhua Instruments Co, Shanghai, Chine). Les cellules symétriques ont été assemblées avec Co/C-700 ou HEC-700 (8:2 avec PVDF en rapport pondéral) comme cathode et anode identiques, et 50 μL d'électrolyte de 1 mol/L LiN(CF3SO2)2, 1% en poids de LiNO3 et 0,2 mol/L de Li2S6 dans une solution DOL/DME (1:1 en volume). Chine) dans la fenêtre de tension de 1,7-2,8 V. La mesure de voltamétrie cyclique (CV) a été effectuée de 1,5 à 3,0 V à une vitesse de balayage de 0,1 mV∙s-1. La spectroscopie d'impédance électrochimique (EIS) a été réalisée dans la gamme de fréquences de 0,1 MHz à 10 mHz avec une amplitude de tension de 5 mV en circuit ouvert. Les mesures CV et EIS ont été effectuées sur une station de travail électrochimique CHI 660E (Chenhua Instruments Co, Shanghai, Chine). Les cellules symétriques ont été assemblées avec Co/C-700 ou HEC-700 (8:2 avec PVDF en rapport pondéral) comme cathode et anode identiques, et 50 μL d'électrolyte de 1 mol/L LiN(CF3SO2)2, 1% en poids de LiNO3 et 0,2 mol/L de Li2S6 dans une solution DOL/DME (1:1 en volume). Chine) dans la fenêtre de tension de 1,7-2,8 V. La mesure de voltamétrie cyclique (CV) a été effectuée de 1,5 à 3,0 V à une vitesse de balayage de 0,1 mV∙s-1. La spectroscopie d'impédance électrochimique (EIS) a été réalisée dans la gamme de fréquences de 0,1 MHz à 10 mHz avec une amplitude de tension de 5 mV en circuit ouvert. Les mesures CV et EIS ont été effectuées sur une station de travail électrochimique CHI 660E (Chenhua Instruments Co, Shanghai, Chine). Les cellules symétriques ont été assemblées avec Co/C-700 ou HEC-700 (8:2 avec PVDF en rapport pondéral) comme cathode et anode identiques, et 50 μL d'électrolyte de 1 mol/L LiN(CF3SO2)2, 1% en poids de LiNO3 et 0,2 mol/L de Li2S6 dans une solution DOL/DME (1:1 en volume). La spectroscopie d'impédance électrochimique (EIS) a été réalisée dans la gamme de fréquences de 0,1 MHz à 10 mHz avec une amplitude de tension de 5 mV en circuit ouvert. Les mesures CV et EIS ont été effectuées sur une station de travail électrochimique CHI 660E (Chenhua Instruments Co, Shanghai, Chine). Les cellules symétriques ont été assemblées avec Co/C-700 ou HEC-700 (8:2 avec PVDF en rapport pondéral) comme cathode et anode identiques, et 50 μL d'électrolyte de 1 mol/L LiN(CF3SO2)2, 1% en poids de LiNO3 et 0,2 mol/L de Li2S6 dans une solution DOL/DME (1:1 en volume). La spectroscopie d'impédance électrochimique (EIS) a été réalisée dans la gamme de fréquences de 0,1 MHz à 10 mHz avec une amplitude de tension de 5 mV en circuit ouvert. Les mesures CV et EIS ont été effectuées sur une station de travail électrochimique CHI 660E (Chenhua Instruments Co, Shanghai, Chine). Les cellules symétriques ont été assemblées avec Co/C-700 ou HEC-700 (8:2 avec PVDF en rapport pondéral) comme cathode et anode identiques, et 50 μL d'électrolyte de 1 mol/L LiN(CF3SO2)2, 1% en poids de LiNO3 et 0,2 mol/L de Li2S6 dans une solution DOL/DME (1:1 en volume).
2 Résultats et discussion
La figure 1 montre l'illustration schématique de la procédure de synthèse pour un composite de carbone dopé au cobalt tridimensionnel (3D). Lorsque le citrate de sodium (SC) a été recuit sous atmosphère inerte, les espèces Na+ se sont transformées en cristaux de Na2CO3 tandis que des nanofeuillets de carbone ultrafins sont apparus à la surface. Lorsque la température augmente encore, les cristaux agissent comme agent d'activation et réagissent avec le carbone enrobé pour former les coquilles poreuses stratifiées. Pendant ce temps, les éléments de cobalt ont été transformés en nanoparticules de Co et intégrés sur une charpente en carbone avec la réduction thermique du carbone.
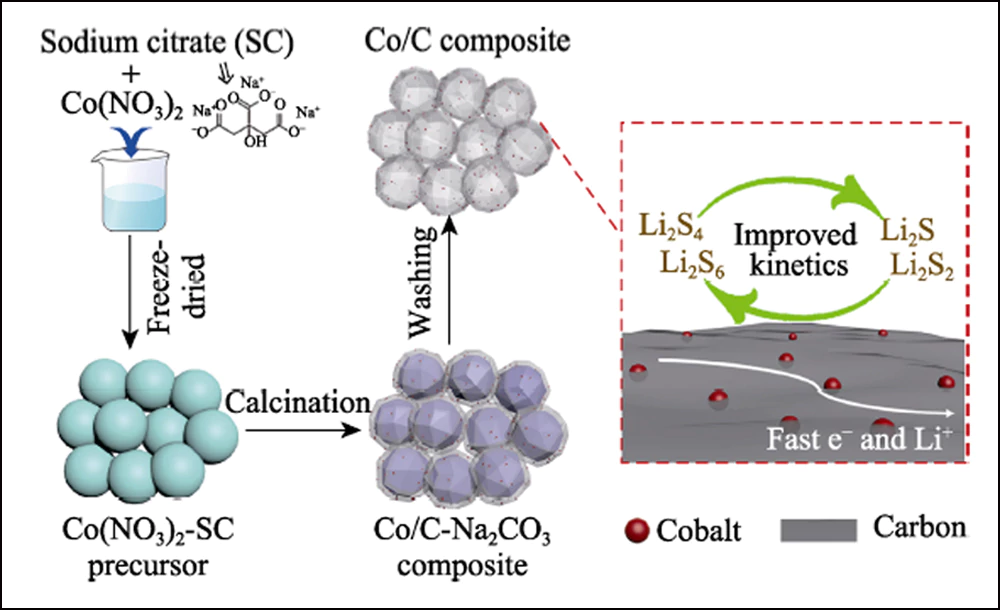
Fig. 1 Illustration schématique des étapes de synthèse du composite Co/C creux et son effet sur l'électrode résultante
La composition et la structure cristalline de l'UWC-700 et du Co/C-700 ont été caractérisées par XRD. Les principaux pics de diffraction de l'UWC-700 (Fig. S1) sont cohérents avec le Na2CO3 monoclinique (PDF # 72-0628), tandis que les trois autres pics à 2θ = 44,2 °, 51,5 ° et 75,9 ° correspondent bien aux données cristallines de Co (PDF #15-0806), indiquant la décomposition totale du SC et la réduction de l'élément cobalt. Le diagramme XRD de Co/C-700 (Fig. 2(a)) avec seulement des pics caractéristiques de cobalt métallique suggère l'élimination complète de Na2CO3. De plus, le large pic évident vers 2θ = 26° représente le plan (002) du carbone graphitisé. Pendant ce temps, comme le montrent les spectres Raman (Fig. 2(b)) de Co/C-700, le rapport d'intensité pour les deux bandes évidentes de D (1382 cm-1) et G (1594 cm-1) est de 0,866, répondant à son degré élevé de graphitisation. En outre, le petit pic à 680 cm-1 est le pic caractéristique du cobalt. La courbe TGA de Co/C-700 est illustrée à la Fig. S2(a) pour garantir la teneur en Co. Le produit final (17,83 % en poids après le test TGA peut être identifié comme étant du Co3O4 (Fig. S2(b)), et la teneur en Co correspondante dans le Co/C-700 est de 13,09 % en poids par calcul, ce qui correspond bien au résultat XPS. (Fig. 2 (c)), les rapports atomique et pondéral de Co sont respectivement de 3,24% at et 13,66% en poids.
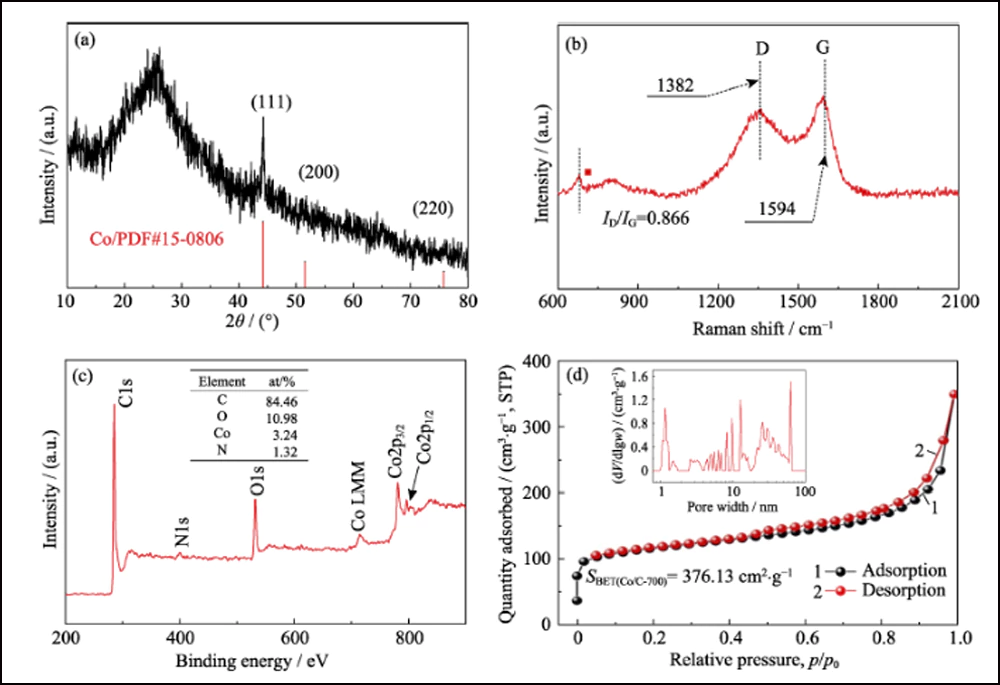
Fig. 2 (a) diagramme XRD, (b) spectre Raman, (c) spectre XPS et (d) isotherme d'adsorption/désorption N2 de Co/C-700 avec insert en (d) montrant la distribution de la taille des pores
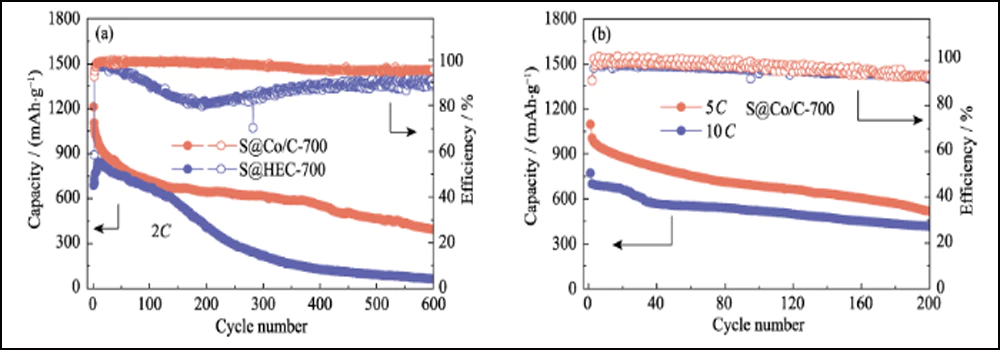
Fig. Diagramme XRD S1 de l'UWC-700
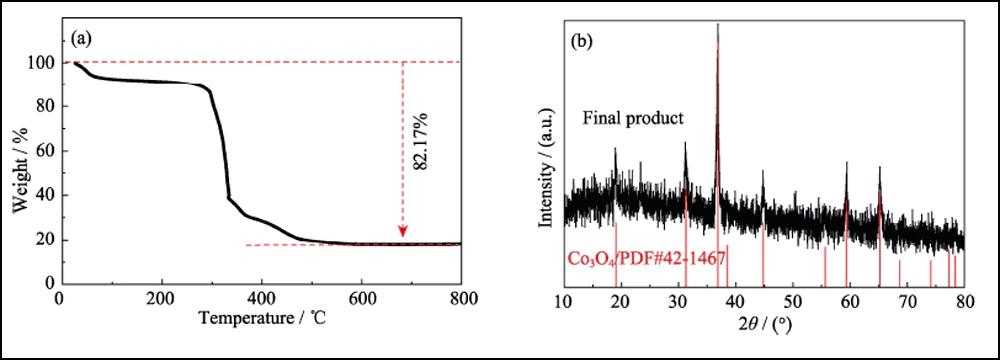
Fig. S2 (a) Courbe TGA de Co/C-700 dans l'air et (b) Diagramme XRD du produit final
La structure poreuse de Co/C a été caractérisée par des méthodes BET. L'isotherme d'adsorption-désorption N2 (Fig. 2 (d)) montre une boucle d'hystérésis distincte, représentant la structure mésoporeuse abondante. La valeur de la surface spécifique et le volume des pores ont été mesurés à 376,13 m2∙g-1 et 0,52 cm3∙g-1, respectivement. La distribution de la taille des pores (encart sur la Fig. 2 (d)) déterminée par la méthode Barrett-Joyner-Halenda (BJH) montre une structure poreuse hiérarchique distincte avec une mésoporosité élevée (62, 76%, tableau S1). Le mésopore interconnecté et la surface élevée peuvent exposer de manière adéquate les sites de cobalt pour l'adsorption et une amélioration supplémentaire de la réaction redox. De plus, les mêmes tests ont été effectués avec les deux autres échantillons, UWC-700 et HEC-700 (Fig. S3). La surface extrêmement faible (15,09 m2∙g-1) et le volume des pores (0. 026 cm3∙g-1) de UWC-700 montrent que la majorité des pores sont remplis de cristaux de Na2CO3. La surface et le volume des pores de HEC-700 sont presque les mêmes que ceux de Co/C-700, ce qui signifie la bonne préservation de la charpente de carbone pendant les étapes de gravure. De plus, le volume de mésopore dans HEC-700 (tableau S1) a augmenté de 5, 4% après gravure, confirmant que les nanoparticules de Co étaient de taille mésoporeuse.
La morphologie et la structure de Co/C-700 ont été caractérisées par SEM (Fig. S4) et TEM (Fig. 3(a, b)). Les particules de Co/C-700 montrent la structure d'une coque de carbone interconnectée en 3D. L'image TEM haute résolution (HRTEM) (Fig. 3 (c)) montre en outre que les franges de réseau de la nanoparticule avec un espacement d de 0, 205 nm correspondent au plan (111) du cobalt métallique. L'espacement d des franges tordues enveloppant la nanoparticule (0,35 nm) est en bon accord avec le plan (002) du carbone graphitique. Les images de cartographie EDS (Fig. 3 (d)) montrent la distribution des éléments Co, C et O, confirmant que l'élément cobalt se disperse uniformément sur les coques en carbone.
Tableau S1 Surface BET et distribution du volume des pores de UWC-700, Co/C-700 et HEC-700
|
Goûter |
SBET/(m2∙g-1) |
Vtotal/(cm3∙g-1) |
Volume des pores e/% |
||
|
Micro |
Méso |
Macro |
|||
|
UWC-700 |
15.09 |
0,026 |
1,76 |
98,24 |
0 |
|
Co/C-700 |
376.13 |
0,52 |
28,85 |
62,76 |
8.49 |
|
HEC-700 |
369,53 |
0,54 |
25.47 |
68.17 |
6.36 |

Fig. 3 (a, b) TEM, (c) images TEM haute résolution (HRTEM) et (d) cartographies élémentaires EDS (Co, C et O) de Co/C-700
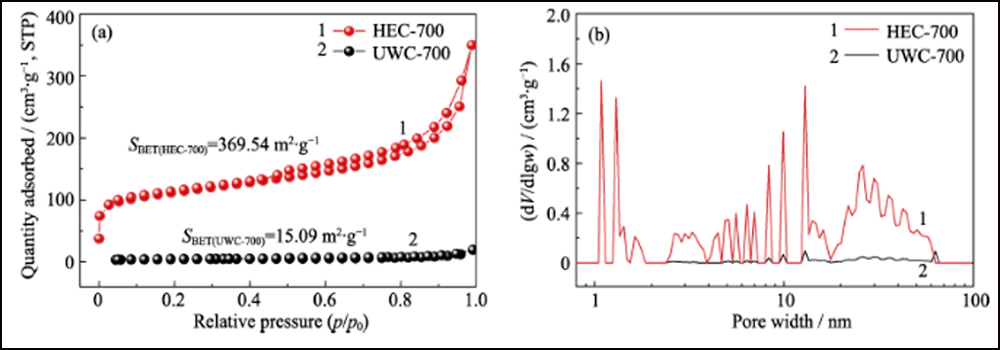
Fig. S3 Isothermes d'adsorption/désorption de N2 (a) et distributions de tailles de pores (b) de UWC-700 et HEC-700

Fig. Image S4 SEM de Co/C-700
Pour confirmer davantage l'effet électrochimique des Conanoparticules dans les batteries Li-S, HEC-700 a été utilisé comme échantillon de contrôle. Le motif XRD, l'image SEM (Fig. S5) et les données BET montrent que HEC-700 possède presque la même structure que Co/C-700, à l'exception de l'existence de l'élément Co. Les électrodes S@Co/C-700 et S@HEC-700 ont été préparées comme cathodes pour les batteries Li-S. Comme le montre la Fig. S6, la principale perte de poids entre la température ambiante et 450 ℃ est attribuée à la sublimation du soufre, correspondant à la teneur en soufre de 70,99 % en poids et 68,42 % en poids dans S@Co/C-700 et S@HEC - 700, respectivement.
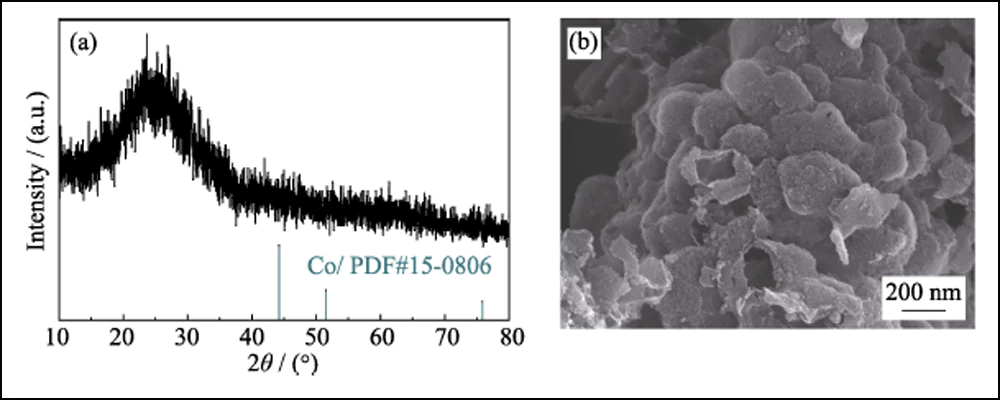
Fig. Modèle XRD S5 (a) et image SEM (b) de HEC-700
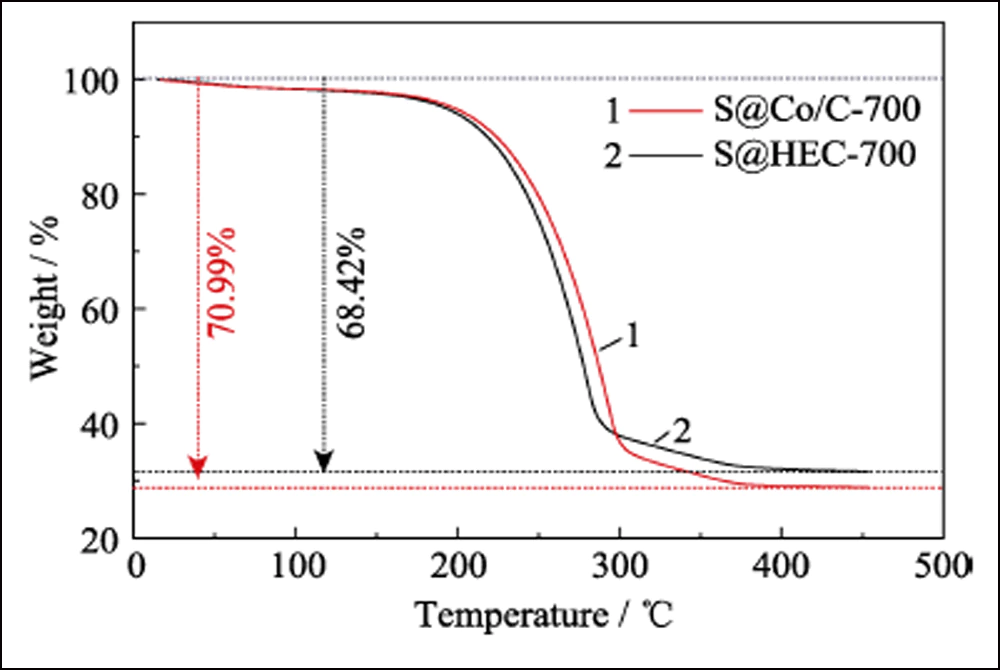
Fig. S6 Courbes TGA de S@Co/C-700 et S@HEC-700 sous atmosphère N2
La composition de surface de S@Co/C-700 a été étudiée par XPS. Le spectre d'enquête (Fig. S7) montre la présence d'éléments S, C, N, O et Co à la surface du composite. Le petit N provient du précurseur de Co(NO3)2. Le taux de soufre extrêmement faible (7,83 at%) indique que le cristal de soufre s'est infiltré avec succès dans la structure poreuse. Le spectre haute résolution de S2p (Fig. 4 (a)) montre quatre pics principaux. Les pics à 164 et 165,2 eV correspondent respectivement aux S2p3/2 et S2p1/2. Les pics situés à 169 et 170,1 eV sont respectivement attribués au thiosulfate et au S-Co. Le spectre C1s est présenté sur la figure 4 (b). Les pics à 284, 8, 285, 6 et 288, 8 eV correspondent aux liaisons CC, CO et O = CO, presque identiques au spectre C1s de Co / C-700 (Fig. S8 (a)). Et le spectre des O1 (Fig. 4(c)) montre le O=C, OC et O = CO à 531,6, 532,4 et 533,4 eV, respectivement. Par rapport au Co/C-700 (Fig. S8(b)), tous ces pics se déplacent de plus de 0,5 eV et vérifient davantage l'interaction entre les groupes fonctionnels soufre et oxygène. De plus, le spectre de Co2p à la Fig. 4(d) montre deux pics principaux de Co2p3/2 et Co2p1/2 à 780,3 et 797,9 eV, qui représentent pour le cobalt métallique. Différent des courbes de Co/C-700 (Fig. S8(c)), deux pics supplémentaires apparaissent à 783,7 et 800,4 eV dans S@Co/C-700 qui suggèrent la forte interaction entre le soufre et le cobalt. Le test d'adsorption statique a été utilisé pour étudier l'interaction entre les LiPS et le Co/C-700 ou le HEC-700 de manière plus intuitive. Et la photographie révèle la solution incolore de Co/C-700 et la couleur presque inchangée de HEC-700 (Fig. S9).
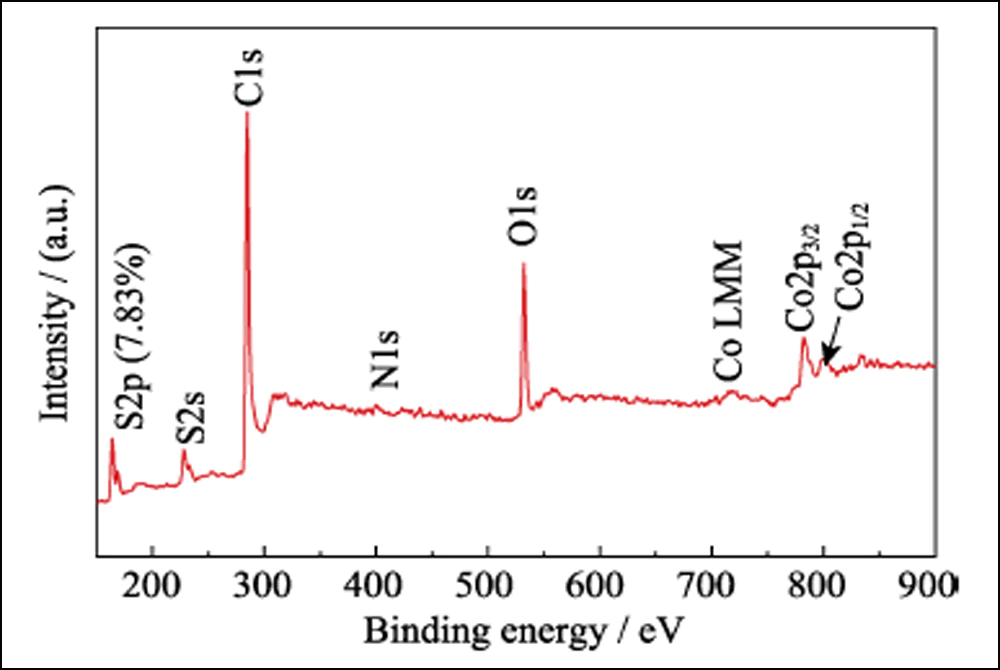
Fig. Spectre S7 XPS du composite S@Co/C-700
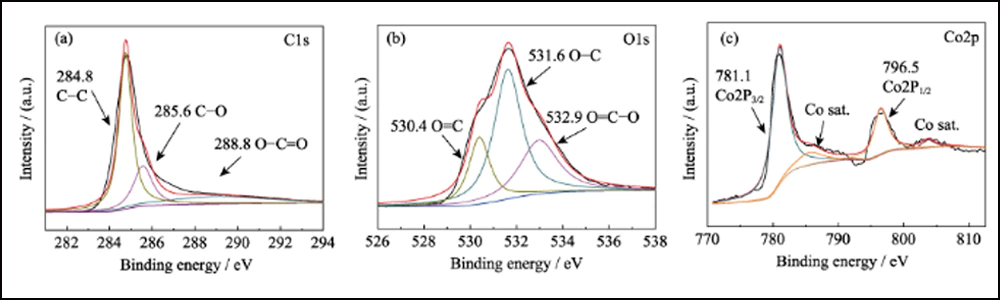
Fig. S8 Spectres XPS haute résolution de Co/C-700(a) C1s ; (b) O1; (c) Co2p
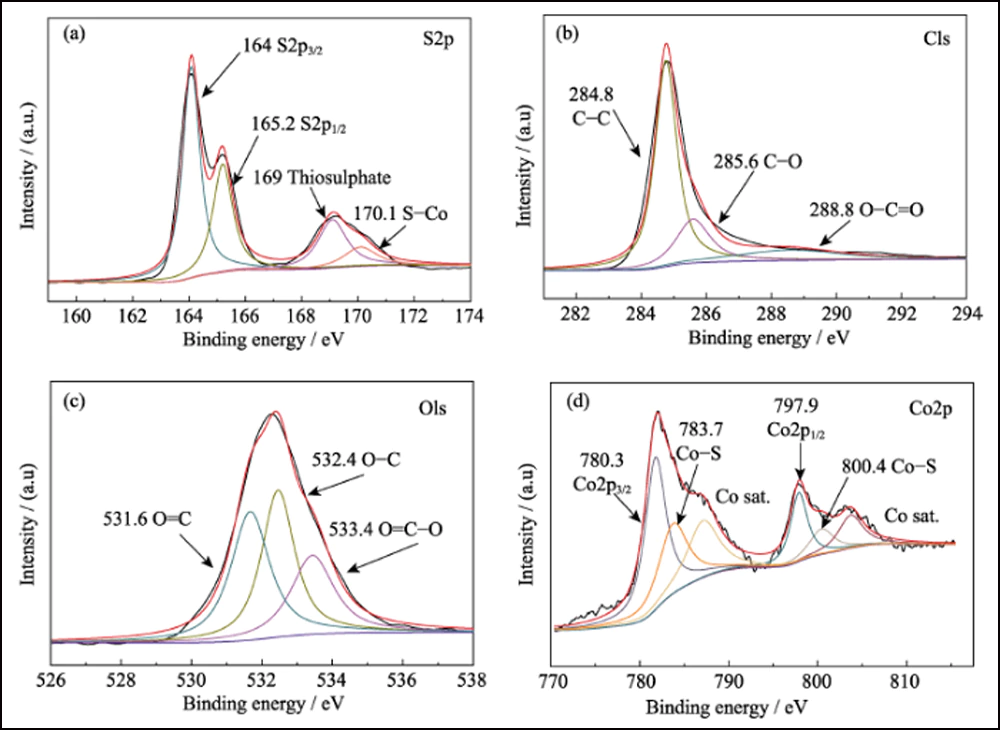
Fig. 4 Spectres XPS haute résolution pour les composites S@Co/C-700
(a) S2p ; (b) les C1 ; (c) O1; (d) Co2p

Fig. S9 Photographie du test d'adsorption statique de HEC-700 et Co/C-700 après repos pendant 1 h
Outre l'adsorption efficace et l'interaction forte, les nanoparticules de cobalt dopant peuvent améliorer efficacement la cinétique de la réaction de conversion entre S8 et Li2S. La voltamétrie cyclique (CV) des cellules symétriques avec des électrodes Co/C-700 et HEC-700 a été utilisée pour confirmer l'effet des nanoparticules de cobalt. Les courbes CV de la Fig. 5 (a) révèlent clairement huit pics redox avec une grande superposition (Fig. S10 (a)). La séparation et la stabilité des pics redox indiquent l'amélioration de la réversibilité et de la cinétique de la réaction de conversion. De plus, la courbe du premier balayage à -1 V révèle trois pics qui représentent la réduction progressive du Li2S6 d'origine au Li2S insoluble sur l'électrode de travail et l'oxydation du Li2S6 sur la contre-électrode. Les quatre pics à -0,112, 0,093, 0,326 et 0. 401 V représentent l'oxydation par étapes de Li2S en soufre élémentaire sur l'électrode de travail. Par conséquent, le pic à 0,112 V correspond à la réduction de S8 à Li2S6. De plus, les pics avec une bonne durabilité sous des taux de balayage plus élevés (Fig. S10 (b)) indiquent également le processus électrochimique efficace basé sur les électrodes Co/C-700. En revanche, le contrôle expérimental des électrodes HEC-700 ne montre que deux paires de pics larges (Fig. 5 (b)) avec la dérive cyclique (Fig. S10 (c)), et les pics discrets à -0,264/0,264 V deviennent invisible sous des taux plus élevés (Fig. S10 (d)), indiquant la cinétique lente et la conversion incomplète de la réaction des polysulfures sans l'existence de nanoparticules de Co. les pics avec une bonne durabilité sous des taux de balayage plus élevés (Fig. S10 (b)) indiquent également le processus électrochimique efficace basé sur les électrodes Co/C-700. En revanche, le contrôle expérimental des électrodes HEC-700 ne montre que deux paires de pics larges (Fig. 5 (b)) avec la dérive cyclique (Fig. S10 (c)), et les pics discrets à -0,264/0,264 V deviennent invisible sous des taux plus élevés (Fig. S10 (d)), indiquant la cinétique lente et la conversion incomplète de la réaction des polysulfures sans l'existence de nanoparticules de Co. les pics avec une bonne durabilité sous des taux de balayage plus élevés (Fig. S10 (b)) indiquent également le processus électrochimique efficace basé sur les électrodes Co/C-700. En revanche, le contrôle expérimental des électrodes HEC-700 ne montre que deux paires de pics larges (Fig. 5 (b)) avec la dérive cyclique (Fig. S10 (c)), et les pics discrets à -0,264/0,264 V deviennent invisible sous des taux plus élevés (Fig. S10 (d)), indiquant la cinétique lente et la conversion incomplète de la réaction des polysulfures sans l'existence de nanoparticules de Co.
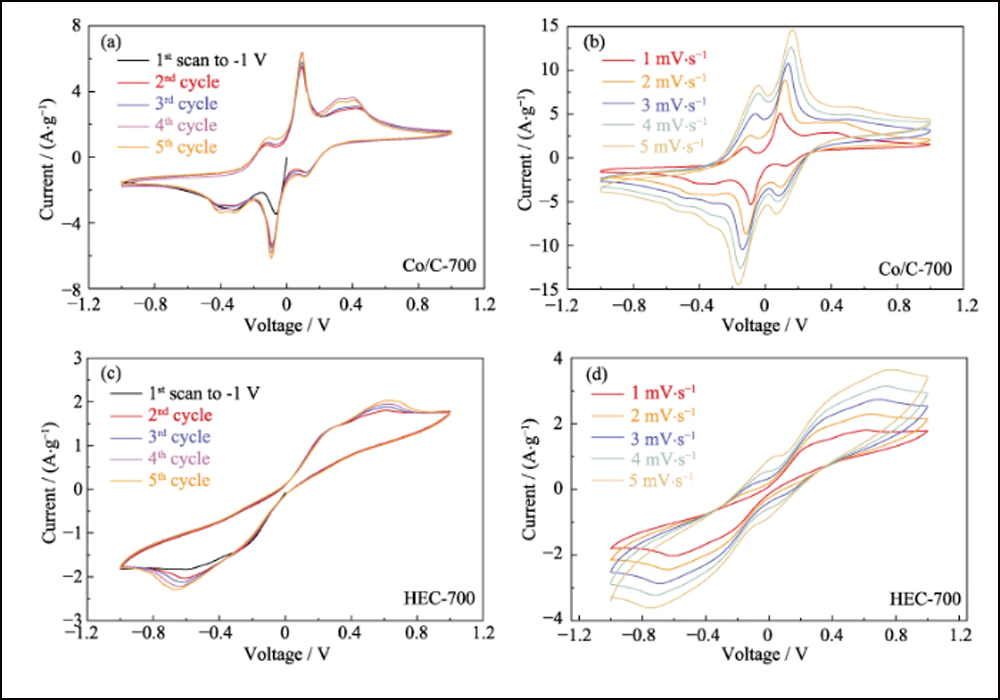
Fig. S10 Courbes CV multi-cycles de cellules symétriques à base de Co/C-700 à 1 mV∙s-1 (a) et taux augmentés (b), et courbes CV multi-cycles de HEC-700 à 1 mV∙s- 1 (c) et taux majorés (d)
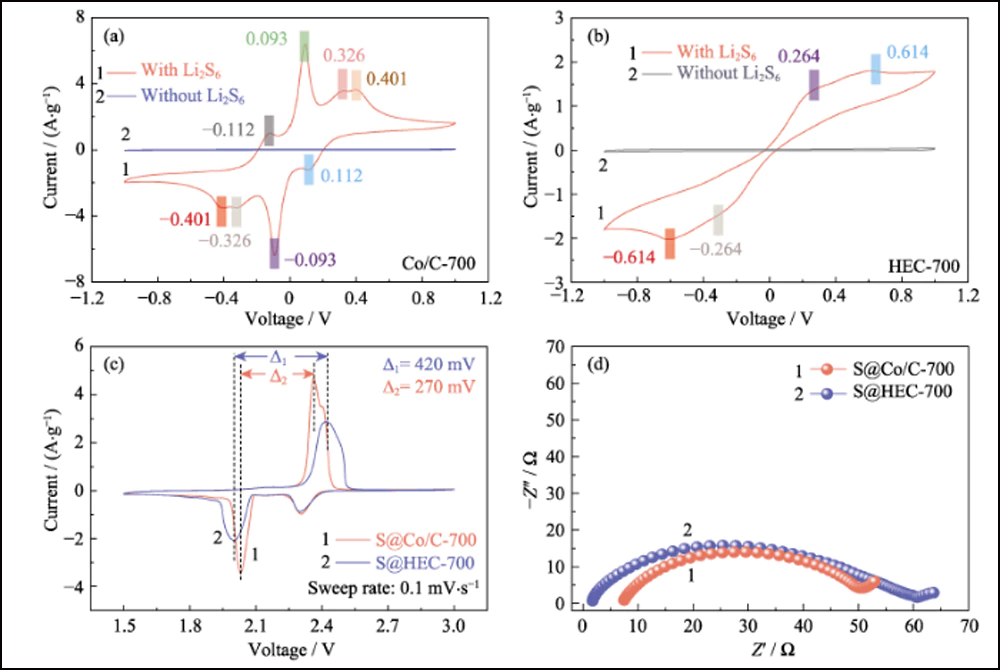
Fig. 5 Courbes CV de (a) Co/C-700 et (b) cellules symétriques à base de HEC-700 avec et sans 0,2 mol∙L-1 Li2S6 à 1 mV∙s-1 ; (c) courbes CV et (d) tracés EIS des électrodes S@Co/C-700 et S@HEC-700
Pour confirmer davantage la cinétique électrochimique améliorée en présence de nanoparticules de cobalt, les tests CV des électrodes S@Co/C-700 et S@HEC-700 (Fig. 5(c)) ont été mesurés à une vitesse de balayage de 0,1 mV∙ s-1. Pour le processus de réduction cathodique de S@Co/C-700, deux pics réversibles à 2,306 et 2,031 V sont associés à la transformation du soufre en LiPS solubles et à une réduction supplémentaire en Li2S2/Li2S insoluble, respectivement. En comparaison, le dernier pic de réduction de S@HEC-700 montre un décalage négatif significatif. Cela suggère une cinétique de réaction plus lente, ce qui peut augmenter le temps de détention des LiPS et aggraver l'effet de navette. Pour le processus anodique, le processus d'oxydation de S@Co/C-700 révèle un pic discret à 2,397 V et un pic majeur à 2,361 V, correspondant à l'oxydation de Li2S2/Li2S en LiPSs puis en soufre, respectivement. La séparation des pics d'oxydation montre la cinétique améliorée de la première réaction. De plus, l'intervalle entre le deuxième pic de réduction et le pic d'oxydation majeur de S@Co/C-700 (270 mV, Fig. 5(c)) est significativement plus petit que celui de S@HEC-700 (420 mV), indiquant la surtension de polarisation réduite et la cinétique améliorée de la réaction redox avec l'existence du cobalt. Les courbes EIS (Fig. 5(d)) montrent une plus petite résistance de transfert de charge (la taille du demi-cercle haute fréquence) de l'électrode S@Co/C-700 (43,1 Ω) que celle de S@HEC-700 (58,7 Ω ), qui révèle également la cinétique de réaction améliorée par le cobalt. 5(c)) est significativement plus petit que celui de S@HEC-700 (420 mV), indiquant la surtension de polarisation réduite et une cinétique améliorée de la réaction redox avec l'existence du cobalt. Les courbes EIS (Fig. 5(d)) montrent une plus petite résistance de transfert de charge (la taille du demi-cercle haute fréquence) de l'électrode S@Co/C-700 (43,1 Ω) que celle de S@HEC-700 (58,7 Ω ), qui révèle également la cinétique de réaction améliorée par le cobalt. 5(c)) est significativement plus petit que celui de S@HEC-700 (420 mV), indiquant la surtension de polarisation réduite et une cinétique améliorée de la réaction redox avec l'existence du cobalt. Les courbes EIS (Fig. 5(d)) montrent une plus petite résistance de transfert de charge (la taille du demi-cercle haute fréquence) de l'électrode S@Co/C-700 (43,1 Ω) que celle de S@HEC-700 (58,7 Ω ), qui révèle également la cinétique de réaction améliorée par le cobalt.
La figure 6 compare les performances électrochimiques des cathodes S@Co/C-700 et S@HEC-700. Les capacités de débit de S@Co/C-700 (Fig. 6(a)) montrent une capacité de décharge initiale beaucoup plus élevée (1280 mAh∙g-1) que S@HEC-700 (847 mAh∙g-1) à la taux de courant de 0,5C (1C = 1672 mAh∙g-1). À des taux de cyclage plus élevés de 1C, 2C, 5C et 10C, les capacités de décharge de la cathode S@Co/C-700 atteignent 1058, 948, 867 et 797 mAh∙g-1, et se rétablissent à 968 mAh∙g-1 à 1C (95 % du 10ème cycle). Et les profils de tension de charge-décharge galvanostatique à différentes vitesses montrent que l'électrode S@Co/C-700 exerce une surtension plus petite et un plateau de décharge beaucoup plus long, même à 10 °C (Fig. S11). Les stabilités de cycle des deux cathodes à un taux de 1C sont comparées sur la figure 6 (b). La cathode S@Co/C-700 montre une capacité initiale élevée de 1244 mAh∙g-1, et maintient 770 mAh∙g-1 après 200 cycles avec une efficacité coulombienne élevée (supérieure à 96 %), révélant une capacité bien supérieure et une meilleure stabilité que le S@HEC-700. Les performances de cyclisme à long terme à 2C présentées sur la figure S12 (a). Après 600 cycles, la cathode S@Co/C-700 a maintenu une capacité de décharge de 401,7 mAh∙g-1 (65,3 mAh∙g-1 pour S@HEC-700). Les taux extrêmement élevés à 5C et 10C sont évalués plus en détail pour la cathode S@Co/C-700 (Fig. S12(b)). Il montre des capacités de décharge initiales élevées (1098 et 772 mAh∙g-1 à 5C et 10C, respectivement) sans aucune étape d'activation et des performances de cyclage stables (518 et 416 mAh∙g-1 à 5C et 10C, respectivement) pendant plus de 200 cycles. La stabilité de cycle et les performances de vitesse plus excellentes de l'électrode S@Co/C-700 sont attribuées aux avantages des nanoparticules de cobalt.
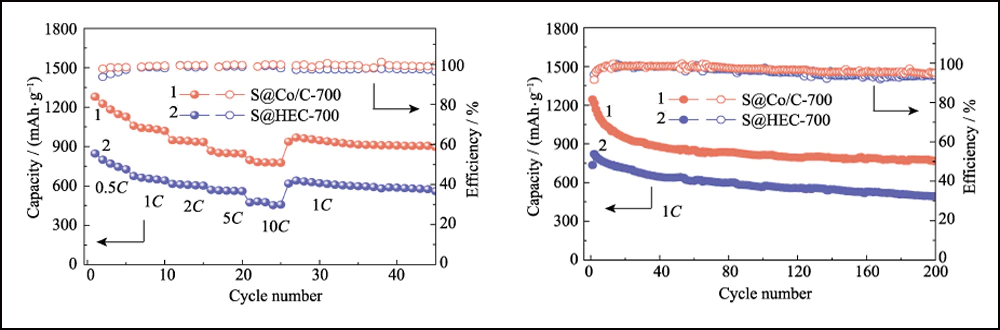
Fig. 6 (a) Capacités de débit à différents débits de 0,5 C à 10 C et (b) stabilités de cycle à 1 C pour les électrodes S@Co/C-700 et S@HEC-700
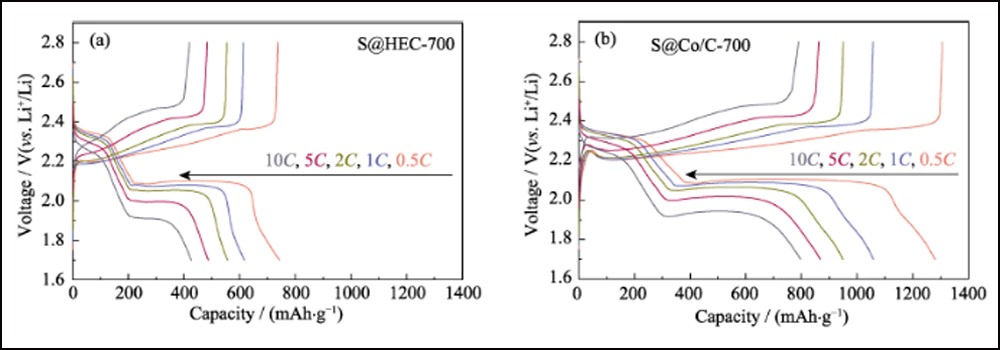
Fig. S11 Profils de tension des électrodes S@HEC-700 (a) et S@Co/C-700 (b) à différentes vitesses de 0,5C à 10C
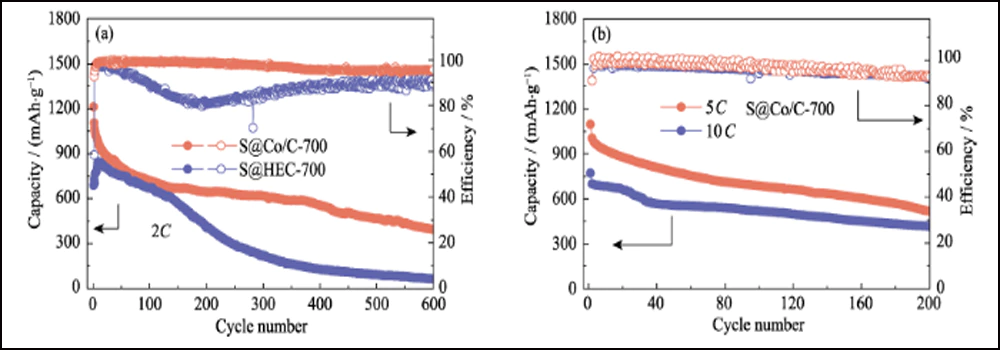
Fig. S12 (a) Stabilités de cyclage des électrodes S@Co/C-700 et S@HEC-700 à 2C ; (b) Performance de cyclage de S@Co/C-700 à 5C et 10C
3Conclusion
En résumé, nous concevons une synthèse à grande échelle de composites Co/C-700 comme matériau hôte pour supporter le soufre pour les batteries Li-S. En combinant les résultats de CV et EIS, nous concluons que les nanoparticules de Co incorporées diminuent le surpotentiel et favorisent la cinétique de conversion des LiPS. De plus, le XPS et le test d'adsorption statique montrent la forte interaction entre les LiPS et le Co dopé. Avec la coopération du Co et la structure poreuse creuse unique, les cathodes S@Co/C-700 obtenues présentent une capacité spécifique élevée de 1280 mAh∙g -1 à 0,5 °C et performances stables à long cycle de 1 °C à 10 °C. Ce travail démontre la faisabilité de batteries Li-S à haute densité d'énergie avec le dopant de cobalt métallique pour des exigences à haut débit.
Matériaux de support
Cadre en carbone creux dopé au cobalt comme hôte de soufre pour la cathode de la batterie au lithium-soufre
JIN Gaoyao, HE Haichuan, WU Jie, ZHANG Mengyuan, LI Yajuan, LIU Younian
Hunan Provincial Key Laboratory of Micro & Nano Materials Interface Science, College of Chemistry and Chemical Engineering, Central South University, Changsha 410083, Chine
Caractérisation des matériaux
Les structures cristallines des échantillons tels que synthétisés ont été caractérisées par diffraction de puissance des rayons X (DRX, Dmax/2550VB, Rigaku, Japon) avec un rayonnement Cu Kα. La morphologie et la microstructure de surface ont été obtenues par microscopie électronique à balayage (SEM, FEI Verios 460). La microscopie électronique à transmission (TEM, JEM-2100F) équipée d'un spectromètre à dispersion d'énergie à rayons X (EDS) a été utilisée pour collecter des images en transmission et à haute résolution du Co/C-700. La teneur en Co dans Co/C-700 et la teneur en S dans S@Co/C-700 ou S@HEC-700 ont été déterminées par un analyseur thermogravimétrique (TGA, Q600, USA) dans l'air ou N2, respectivement, avec une vitesse de chauffage de 10 ℃∙min-1. La spectroscopie Raman a été réalisée à l'aide d'un système Raman reflex (Renishaw in Via Raman microscope, UK) équipé d'un microscope sous rayonnement laser 532 nm à 50 mW. L'analyse par spectromètre photoélectronique à rayons X (XPS) a été effectuée sur un spectromètre photoélectronique à rayons X ESCALAB 250XI (Thermo Fisher Scientific, États-Unis). La surface spécifique et la distribution de la taille des pores des échantillons ont été déterminées par analyse d'adsorption-désorption d'azote.
Adsorption statique des polysulfures
Typiquement, une solution de Li2S6 à 0,003 mol/L a été obtenue en faisant réagir du Li2S et du S stoechiométriques dans du 1,2-diméthoxyéthane (DME) et du 1,3-dioxolane (DOL) (1 : 1 en volume) à 60 °C pendant 24 h. Ensuite, 10 mg de Co/C-700 ou HEC-700 ont été ajoutés dans 3 ml de la solution de polysulfure de lithium. La photographie a été prise après que l'échantillon ait reposé pendant 1 h.