Progrès récents sur anode pour batteries au lithium tout solide à base de sulfure
ââ Partie 1 Anode en lithium métallique
Auteur :
JIA Linan, DU Yibo, GUO Bangjun, ZHANG Xi
1. École de génie mécanique, Université Jiao Tong de Shanghai, Shanghai 200241, Chine
2. Shanghai Yili nouvelle technologie énergétique cie., LTD. , Shanghai 201306, Chine
Résumé
Les batteries au lithium entièrement solides (ASSLB) présentent une densité énergétique plus élevée et plus de sécurité que les batteries au lithium liquide actuelles, qui sont les principales orientation de recherche pour les dispositifs de stockage d’énergie de nouvelle génération. Par rapport à d'autres électrolytes à l'état solide, les électrolytes sulfurés à l'état solide (ESS) ont les caractéristiques de conductivité ionique ultra-élevée, de faible dureté, facile traitement et un bon contact interfacial, qui sont l'un des plus prometteurs voies pour réaliser des batteries entièrement solides. Cependant, il existe certains problèmes d'interface entre les anodes et les SSE qui limitent leurs applications telles que comme des réactions secondaires interfaciales, un mauvais contact rigide et des dendrites de lithium. Ce L'étude décrit les progrès actuels dans les matériaux d'anode utilisés pour les matériaux à base de sulfure. ASSLB, résume l'état de développement, les avantages de l'application, l'interface problèmes et stratégies de solution principales des principaux matériaux d'anode y compris le lithium métal, les alliages de lithium, l'anode en silicium pour les produits à base de sulfure ASSLB, et fournit des suggestions d'orientation pour le prochain développement d'anodes matériaux et la solution des problèmes d'interface.
Mots-clésï¼ tout solide piles au lithium ; électrolyte sulfuré ; anode au lithium ; anode en alliage ; anode/électrolyte interfaces
Introduction
Les batteries lithium-ion sont largement utilisées dans divers appareils portables en raison de leur haute tension et de leur haute densité énergétique. Ils constituent un produit industriel clé pour l’électrification des véhicules et le déploiement de systèmes de stockage d’énergie dans une société bas carbone. Cependant, le liquide les batteries lithium-ion utilisent des électrodes négatives en graphite, un liquide organique électrolytes et électrodes positives en oxyde de lithium métallique (telles que LiCoO2). D'une part, l'énergie spécifique des batteries assemblées est limitée à la plage de 200 ~ 250 W·h·kg-1, ce qui rend difficile d'atteindre davantage percées dans l’énergie spécifique. En revanche, les électrolytes organiques ont inconvénients tels qu'une mauvaise stabilité thermique et une inflammabilité. De plus, le les dendrites de lithium générées pendant le cycle de la batterie entraîneront également d'énormes risques de court-circuit de la batterie, voire d'explosion. Cette série de problèmes a causé de nombreux chercheurs doivent prêter attention et réfléchir à la sécurité du lithium-ion piles. Remplacement des électrolytes liquides organiques inflammables par des électrolytes solides les électrolytes peuvent fondamentalement empêcher l'emballement thermique et résoudre le problème de sécurité dangers causés par les électrolytes liquides inflammables utilisés dans le lithium-ion liquide piles. Dans le même temps, les propriétés mécaniques élevées du solide les électrolytes sont également considérés comme l’une des percées dans l’inhibition la croissance des dendrites de lithium.
Actuellement, le grand public à semi-conducteurs Les électrolytes comprennent quatre types : électrolyte sulfuré à l'état solide, oxyde électrolyte à l'état solide, électrolyte à l'état solide polymère et halogénure à l'état solide électrolyte. Parmi eux, les électrolytes oxydes présentent les avantages d'une bonne stabilité et conductivité ionique modérée, mais ont un mauvais contact d'interface. Les électrolytes polymères ont une bonne stabilité au lithium métal et ont relativement technologie de traitement mature, mais mauvaise stabilité thermique, étroite les fenêtres électrochimiques et la faible conductivité ionique limitent la portée de application. En tant que nouveau type d'électrolyte, les électrolytes halogénures ont reçu grande attention en raison de leur conductivité ionique élevée. Cependant, le haut les éléments métalliques de valence dans les électrolytes halogénures déterminent qu'ils ne peuvent pas Contactez directement le lithium métal pour former une interface anodique stable. Recherche sur les électrolytes halogénures nécessitent une exploration plus approfondie. Les électrolytes sulfurés sont considéré comme l'une des voies les plus prometteuses pour réaliser des systèmes entièrement à l'état solide. électrolytes des batteries au lithium (ASSLB) en raison de leur haute conductivité ionique, faible dureté, traitement facile, bonne formabilité et bon contact d'interface.
Ces dernières années, des recherches connexes sur les sulfures les électrolytes ont été développés davantage et leur conductivité ionique a atteint un niveau comparable à celui des électrolytes organiques liquides. Sulfure typique les électrolytes comprennent le sulfure vitreux Li-P-S (LPS) et les vitrocéramiques dérivées, minerai de germanium de sulfure d'argent (Li6PS5X, X = Cl, Br, I) et ion sulfure de lithium supraconducteurs (conducteur superionique thio-lithium, thio-LISICON), Li10GeP2S12 (LGPS) et composés similaires.
Parmi ces différents matériaux sulfurés, Les électrolytes de type LGPS présentent de loin la meilleure conductivité ionique. En 2016, Kato et coll. a rapporté le conducteur d'ions superlithium Li9.54Si1.74P1.44S11.7Cl0.3 (LSPSCl), dont la conductivité ionique atteint 25 × 10-2 S · cm-1 dans la pièce température. LGPS a également une conductivité ionique ultra-élevée de 1,2 × 10-2 S · cm-1 à température ambiante. La faible conductivité ionique anisotrope du LGPS monocristallin dans la direction (001) atteint même 27 × 10-2 S · cm-1. Vitrocéramique (Li7P3S11) et le sulfure-germanite (Li6PS5Cl) peuvent atteindre des conductivités ioniques élevées de 10-3 S·cm-1. Batteries entièrement solides combinant des électrolytes sulfurés avec cathodes en couches à haute teneur en nickel et anodes à haute énergie (telles que Si ou métallique lithium) peut même présenter une énergie spécifique ultra-élevée de 500 kW·h·kg-1. Cependant, l'application d'électrolytes sulfurés dans les batteries au lithium entièrement solides a encore des problèmes tels qu'une fenêtre électrochimique étroite, un mauvais Stabilité de l'interface électrode-électrolyte, mauvaise stabilité de l'air, manque de méthodes de fabrication à grande échelle et coût élevé. L'électrochimie étroite La fenêtre détermine que la réaction de réduction de l'électrolyte se produira lorsque l'électrolyte sulfure actif entre en contact avec la plupart des points négatifs Électrodes, entraînant une instabilité de l'interface, ce qui est un facteur important goulot d'étranglement limitant le développement de batteries au lithium entièrement solides. Cet article résume principalement l'état de développement de l'anode grand public matériaux pour batteries au lithium tout solide à base d'électrolytes sulfurés, et résume en outre les problèmes d'interface et les stratégies de solution entre électrolytes solides sulfurés et matériaux d'anode. Fournir des suggestions d’orientation pour le développement et l'application commerciale de batteries au lithium entièrement solides à base d'électrolytes sulfurés.
1 Anode au lithium métallique
1.1 Électrolyte lithium/sulfure stabilité chimique de l'interface
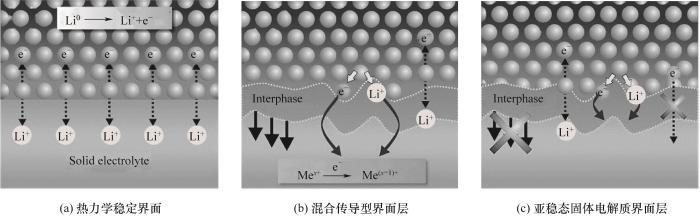
Fig.1 Types d'interfaces entre le lithium métal et électrolyte solide
(1) Interface thermodynamiquement stable : Comme montré sur la figure 1(a), les deux phases en contact sont dans un état thermodynamique équilibre. Le lithium métallique ne réagit pas du tout avec l'électrolyte, formant un plan bidimensionnel pointu, tel que LiF, Li3N et autres binaires au lithium composés.
(2) Interface thermodynamiquement instable : En raison de la réaction chimique thermodynamique entre les éléments en contact électrolyte et électrode, une couche d'interface tridimensionnelle peut être formée. Selon que la couche d'interface formée par le produit de réaction présente ou non conductivité électronique et ionique suffisante, on peut le distinguer davantage dans les deux interfaces suivantes.
â Couche d'interface conductrice mixte : lorsque le Le produit a une conductivité électronique et ionique suffisante, la couche d'interface peut se développer de manière stable dans l'électrolyte solide. La formation de cet hybride la couche intermédiaire conductrice permettra à terme le transport des électrons à travers le électrolyte, entraînant une auto-décharge de la batterie [Figure 1 (b)]. Le l'instabilité interfaciale des électrolytes solides sulfurés conduit à la génération de réactions secondaires interfaciales, qui peuvent provoquer une atténuation rapide de la batterie capacité, voire échec. Wenzel et coll. photoélectron à rayons X utilisé in situ spectroscopie (XPS) combinée à des mesures électrochimiques résolues dans le temps. Informations détaillées sur la réaction chimique à l'interface entre le LGPS et du lithium métallique est fourni, et il est vérifié que la décomposition du LGPS conduit à la formation d'une phase d'interface électrolytique solide composée de Li3P, Alliages Li2S et Li-Ge. Parmi eux, Li3P et Li2S sont des conducteurs ioniques, et L'alliage Li-Ge est un conducteur électronique. La couche d'interface conductrice mixte formé entraînera la décomposition continue du LGPS et l'électrode négative l'impédance de l'interface continuera à augmenter, conduisant finalement à la batterie échec.
â¡Interface électrolyte solide métastable couche : si le produit de réaction est non conducteur ou n'a qu'un faible niveau électronique conductivité, la couche d'interface peut être limitée pour se développer en un film très mince, et une interphase électrolytique stable, SEI, peut être formée. . Comme indiqué sur la figure 1 (c), les performances de cette batterie dépendront de l'ion propriétés de conduction du SEI. L'électrolyte de type sulfure-germanite est relativement stable, et ses produits de décomposition Li2S, Li3P et LiX (X=Cl, Br et I) ont une conductivité électronique suffisamment faible pour éviter une décomposition continue de l'électrolyte et forment facilement un SEI stable. Parallèlement, Li3P a conductivité ionique élevée, assurant une transmission efficace des ions lithium dans piles à semi-conducteurs.
1.2 Recherches sur la mécanique propriétés du lithium métal
Le contact d'interface solide-solide actuel entre l'électrode négative et l'électrolyte solide est un point limité contact, ce qui conduit facilement à une augmentation de la résistance d'interface. Cependant, les propriétés mécaniques du lithium métallique, en particulier le fluage du lithium métallique Le lithium, affectera davantage l'effet de contact d'interface, conduisant au formation de vides d'interface et même délaminage des électrodes négatives à haute température densités actuelles. Par conséquent, étudier les propriétés mécaniques du métal le lithium, en particulier le comportement au fluage du lithium métallique, est crucial pour le stabilité du cycle des batteries entièrement solides.
Tian et coll. mécanique des contacts conduits recherche et établissement de modèles théoriques pertinents pour obtenir la limite conditions qui affectent la fonction de répartition des contraintes des éléments élastiques, plastiques et contacts visqueux sur l'anode lithium métal. Prédire la zone de contact du interface d'électrolyte solide de sulfure de lithium métallique et calculer la capacité perte causée par la diffusion des ions à l’interface et perte de surface de contact. Les expériences montrent qu'à une tension de coupure inférieure (3,8 V), la relation entre la diminution de la capacité de la batterie et la perte de surface de contact est presque linéaire, avec une pente de 1. À une tension de coupure plus élevée (4,0 V), la pente est inférieur à 1, et le taux de chute de capacité diminue avec l'augmentation de la décharge taux. Fincher et coll. utilisé des expériences de traction pour tester les effets mécaniques de feuille de lithium commerciale et a découvert que la limite d'élasticité du lithium métallique variait de 0,57 à 1,26 MPa à une vitesse de déformation de 5 × 10-4 ~ 5 × 10-1 s-1. Pour le test d'indentation avec un objectif de 0,05 sâ1, la dureté a fortement chuté de près de 43,0 MPa à 7,5 MPa lorsque la profondeur d'indentation augmente de 250 nm à 10 µm. Les propriétés plastiques mesurées à partir de tests de nanoindentation ont montré de fortes dépendance à la vitesse de déformation avec des exposants de contrainte de 6,55 et 6,90 respectivement. L'analyse par éléments finis est utilisée pour relier la profondeur d'indentation à la longueur pertinente balances dans les applications de batteries. Il peut fournir des conseils importants pour optimiser la structure des anodes de lithium et assurer la charge et la décharge Stabilité, afin de réduire le dépôt inégal de lithium pendant cycles électrochimiques. Masias et coll. mesuré systématiquement l'élastique, propriétés plastiques et mécaniques dépendant du temps du lithium polycristallin à température ambiante. Son module d'Young, son module de cisaillement et son coefficient de Poisson étaient déterminé à 7,82 GPa, 2,83 GPa et 0,38 respectivement, et le rendement la résistance était comprise entre 0,73 et 0,81 GPa. La dérive de la loi de puissance domine sous tension, avec un indice de contrainte de 6,56. Les tests de compression ont été effectués dans la plage de contraintes pertinente pour la batterie (0,8 ~ 2,4 MPa), et des bandes significatives et un une diminution du taux de déformation avec le temps a été observée. Narayan et coll. établi un modèle de réponse pour une anode au lithium pour batterie entièrement solide basée sur de grandes théorie de la déformation, simulant l'interaction entre l'anode au lithium et l'électrolyte solide sulfuré dans la réaction élastique-viscoplastique du lithium. Cela montre que la réaction de déformation est liée à la déformation volumique de anode au lithium, qui est la principale raison de la défaillance des composants à semi-conducteurs piles. Grâce à des tests de traction et de nanoindentation par lots, le lithium métal montre dépendance évidente à la vitesse de déformation et à la décroissance de la taille pendant le fluage. a montré que un réglage fin de la mécanique de la déformation peut être obtenu en ajustant le lithium Dépôts pour améliorer la robustesse de l'anode de lithium et atténuer les instables croissance du lithium au cours du cycle électrochimique.
En complément de l'étude mécanique globale du lithium métallique, l'étude de la nanomécanique fournit des informations assez importantes et des informations de surface et locales extrêmement détaillées à petite échelle. Les expériences de nanoindentation sont l'un des outils d'analyse les plus couramment utilisés pour les caractéristiques de surface et locales. Expériences de nanoindentation réalisées dans Le gaz inerte peut analyser de manière plus complète les paramètres mécaniques, électrochimiques et comportements de couplage morphologique du lithium métallique. Herbert et coll. mené une série d'expériences de nanoindentation sur des films de lithium évaporé de haute pureté et collecté des données sur les caractéristiques d'écoulement du plastique, y compris le module élastique, dureté et limite d'élasticité. L'évolution des données ci-dessus avec des variables clés telles que l'échelle de longueur, la vitesse de déformation, la température, l'orientation cristallographique et le cycle électrochimique a été étudié, indiquant que l'écoulement plastique de le lithium est principalement lié au fluage en régime permanent sous charge constante ou pression. Le fluage du lithium lors de la charge et de la décharge électrochimiques peut induire un flambage à l’interface et générer des contraintes supplémentaires. Au en même temps, le comportement viscoplastique du lithium affectera davantage le zone de contact de l'interface, conduisant à la détérioration des canaux de diffusion ionique et l'instabilité de l'interface. Cependant, les recherches nanomécaniques actuelles sur le lithium métallique en est encore à son stade préliminaire et des recherches plus approfondies sont en cours. très important. Certaines nouvelles technologies telles que la compression des nanocolonnes et L'observation in situ et en temps réel de la nanomécanique du lithium métallique a également été proposé d'analyser le couplage de l'interface de l'anode métallique au lithium et fournir des informations haute fidélité sur l'interface pour mieux comprendre le effet de couplage mécanique du lithium métallique, offrant ainsi la possibilité pour la conception d'anodes de lithium métalliques à l'échelle nanométrique.
1.3 Nucléation et croissance du lithium dendrites
Les dendrites de lithium sont l'une des problèmes fondamentaux affectant la stabilité et la sécurité des batteries lithium-ion. Les électrolytes solides ont longtemps été considérés comme une solution potentielle au lithium croissance des dendrites en raison de leur haute résistance mécanique. Cependant, de nombreux les résultats de la recherche montrent que le problème des dendrites de lithium dans les solides les électrolytes existent toujours, et c'est encore plus grave que dans le lithium liquide piles. Dans le cas des batteries à semi-conducteurs, de nombreuses raisons expliquent la croissance de dendrites de lithium, y compris un contact irrégulier à l'interface entre les électrolyte et lithium métallique, défauts, joints de grains, vides dans le électrolyte, charges d'espace, etc. Monroe et al. signalé une dendrite de lithium modèle de croissance basé sur une anode de lithium métallique et un électrolyte solide. Facteurs Tels que l'élasticité de l'électrolyte, la force de compression, la tension superficielle et Les forces de déformation ont été prises en compte dans le modèle. Les résultats de simulation montrent que lorsque le module de cisaillement de l'électrolyte est équivalent à celui du lithium, un une interface stable sera formée. Lorsque le module de cisaillement de l'électrolyte est environ deux fois celle du lithium (4,8 GPa), la génération de lithium les dendrites peuvent être supprimées. Cependant, dans la batterie au lithium entièrement solide recherche, il a été constaté que les dendrites de lithium sont toujours produites sous forme solide électrolytes à module de cisaillement élevé [tels que Li7La3Zr2012 (LLZO), élastique module â 100 GPa]. Par conséquent, ce modèle n’est applicable qu’à l’idéal Interfaces sans défauts microscopiques ni répartition inégale. Porz et coll. constaté que le module de cisaillement élevé de l'électrolyte conduira à une valeur ultime élevée densité de courant, induisant la nucléation et la croissance du lithium métallique dans le les joints de grains et les vides de l'électrolyte solide. Nagao et coll. utilisé sur place microscopie électronique à balayage pour observer le dépôt et la dissolution du lithium processus à l'interface de l'électrode négative dans le lithium entièrement solide batteries, révélant les changements dans la morphologie des dépôts de lithium avec différentes densités de courant appliquées. Lorsque la densité de courant dépasse 1 mA·cm-2, le dépôt local de lithium provoquera des fissures plus importantes, entraînant une réduction de la réversibilité du dépôt et de la dissolution du lithium, et la les fissures s'étendront davantage jusqu'à ce que des dendrites de lithium se forment. De l'autre un dépôt et une dissolution manuels et uniformes du lithium peuvent être obtenus à une faible densité de courant de 0,01 mA·cm-2, avec presque aucune fissure. Donc, se concentrer uniquement sur le module de cisaillement élevé de l'électrolyte ne peut pas résoudre le problème. problème de croissance des dendrites de lithium et peut réduire la conductivité ionique de l'électrolyte et affectent la densité énergétique des batteries à semi-conducteurs.
Porz et coll. étudié la nucléation et mécanisme de croissance des dendrites de lithium dans divers électrolytes et a montré que le début de la pénétration du lithium dépend de la morphologie de surface du solide électrolyte. En particulier, la taille et la densité des défauts, ainsi que le dépôt La présence de lithium dans les défauts peut créer des contraintes à la pointe qui favorisent la propagation des fissures. Dans De plus, les différences de conductivité entre les grains, les joints de grains ou les interfaces peuvent également conduire à la génération de dendrites de lithium. Yu et coll. théoriquement étudié l'énergétique, la composition et les propriétés de transport de trois joints de grains inclinés symétriquement à faible énergie dans des électrolytes solides. Cela montre que le transport des ions lithium aux joints de grains est plus important. difficile que dans les grains et est sensible à la température et aux joints de grains structure. Raj et coll. théoriquement étudié l'effet des joints de grains résistance à la nucléation des dendrites de lithium au niveau du solide interface électrolyte/lithium. Ils ont proposé que la haute résistivité ionique de les joints de grains et les irrégularités physiques de l'interface anodique conduirait à une augmentation du potentiel mécanique électrochimique local de lithium, favorisant ainsi la formation de dendrites de lithium. Donc, par rapport aux grains cristallins, les joints de grains à haute résistivité ionique sont plus susceptible d'induire la nucléation et la croissance des dendrites de lithium. Le Le mécanisme de croissance des dendrites de lithium dans les batteries entièrement solides a deviendra progressivement plus clair au fil des recherches ultérieures. Cependant, il manque encore de moyens efficaces pour supprimer complètement les dendrites de lithium, et connexes la recherche doit continuer à être approfondie pour réaliser l’application de anodes métalliques au lithium dans les batteries entièrement solides dès que possible.
1.4 Stratégies de résolution de problèmes d'interface
De nombreuses méthodes ont été proposées pour résoudre les défis liés à l'application des anodes au lithium, y compris l'application pression externe, utilisation de couches SEI, optimisation des électrolytes et modification du lithium métallique. Cela réduit l'impact du fluage du lithium sur la batterie, augmente la zone de contact de l'interface solide-solide, inhibe réactions secondaires à l’interface entre l’électrolyte solide sulfuré et le anode de lithium métallique, améliore la lithophile de l'interface anodique, et évite la formation et la croissance de dendrites de lithium.
1.4.1 Appliquer une pression externe
L'application d'une pression externe peut augmenter la zone de contact de l'interface solide-solide, réduit les dommages causés par le fluage à L'interface d'électrode négative et améliore la stabilité du cycle du batterie. Zhang et coll. signalé un phénomène tridimensionnel multi-échelle dépendant du temps modèle de contact pour décrire l'évolution de l'anode électrolyte solide/lithium interface sous pression de pile. Les calculs théoriques montrent que la pile élevée des pressions d'environ 20 GPa ont tendance à inhiber la formation de vides, une solution prometteuse Méthode pour assurer un contact d'interface cohérent, obtenant potentiellement une stabilité performances de la batterie. Une pression de pile plus élevée n’est pas plus bénéfique pour la batterie performance. Une pression de cheminée inférieure ne peut pas résoudre fondamentalement le contact problème à l'interface solide-solide. Une pression excessive dans la pile peut facilement se former dendrites de lithium et provoquer des courts-circuits dans la batterie. Wang et coll. étudié l'effet de la pression de la cheminée sur les performances de l'électrolyte lithium/sulfure batteries et a constaté que pendant le processus de décapage du lithium, le maximum La densité de courant de dénudage admissible est proportionnelle à la puissance externe appliquée. pression. Pendant le processus de dépôt, une pression appliquée plus élevée réduira le courant de dépôt maximum autorisé, c'est-à-dire une pression d'empilement élevée conduisent facilement à la génération de dendrites de lithium (Figure 2).
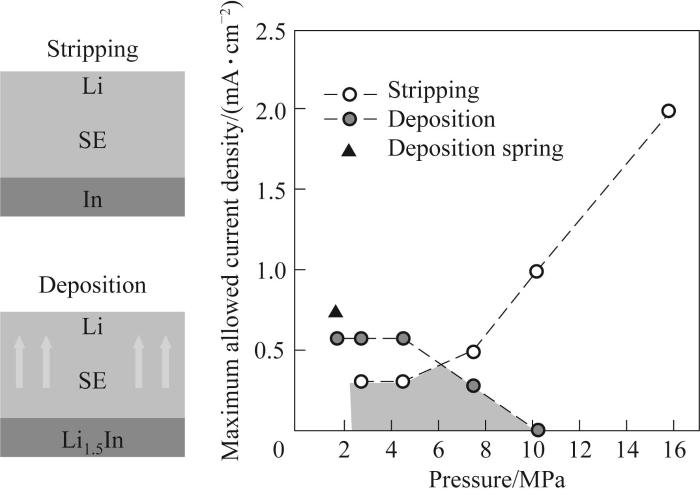
Fig.2 Relation entre le courant maximum autorisé densité (MACD) et pression externe pour le décapage et le dépôt dans les ASSLB
1.4.2 Électrolyte solide artificiel couche d'interface
Placer un SEI stable sur le solide sulfuré L'interface électrolyte/lithium peut éviter le contact direct entre le lithium métallique et l'électrolyte solide sulfuré, inhibant efficacement l'apparition de réactions secondaires d’interface et formation et croissance de dendrites de lithium. Généralement, il existe deux méthodes de formation du SEI : le SEI in situ et le SEI ex situ. Wang et coll. établi une couche protectrice conductrice d'ions in situ sur le surface du lithium métal poli grâce à la technologie de revêtement par rotation. Un mélange de le polyacrylonitrile (PAN) et le carbonate de fluoroéthylène (FEC) sont utilisés pour intégrer un couche protectrice artificielle (LiPFG) composée d'une matrice organique de matières inorganiques Li3N et LiF à la surface du lithium. Favorise efficacement le dépôt uniforme de lithium et améliore la stabilité et la compatibilité de l'interface. Li et coll. conçu une couche intermédiaire polymérisée in situ de 1,3-dioxolane dans du lithium difluoro(oxalate)phosphate. Le SEI formé à l'interface Li/LGPS a un structure à double couche. La couche supérieure est riche en polymères et est élastique, et la couche inférieure est pleine de substances inorganiques pour inhiber la nucléation et croissance des dendrites de lithium. Dans le même temps, le contact continu du L'interface Li/LGPS est obtenue, ce qui favorise la transmission uniforme de ions lithium et inhibe la décomposition continue du LGPS. Lithium Les batteries symétriques avec ce revêtement polymère gel présentent un cycle stable sur 500 h dans les conditions de 0,5 mA·cm-2/0,5 mA·h·cm-2. Gao et coll. a signalé un nanocomposite à base de sels élastiques organiques [LiO-(CH2O) n -Li] et inorganiques sels de nanoparticules (LiF, -NSO2-Li, Li2O), qui peuvent être utilisés comme intermédiaire phase pour protéger le LGPS. Le matériau nanocomposite est formé in situ sur Li Grâce à la décomposition électrochimique de l'électrolyte liquide, ce qui réduit la résistance d'interface, a une bonne stabilité chimique et électrochimique et compatibilité d'interface et inhibe efficacement l'apparition de LGPS réaction de réduction. Dépôt de lithium stable de plus de 3000 h et un cycle une durée de vie de 200 fois a été atteinte. La résistance mécanique du SEI est extrêmement important pour la stabilité du cycle des batteries entièrement solides. Si le la résistance mécanique du SEI est trop faible, une pénétration des dendrites se produira. Si le Le SEI n'est pas assez résistant, des fissures de flexion se produiront [Fig. 3(a)]. Duan et coll. préparé une couche de LiI structurée par dépôt chimique en phase vapeur d'iode comme SEI artificiel entre le lithium métallique et le LGPS [Figure 3 (b)]. La couche LiI généré in situ possède un cristal LiI unique et mince en forme de riz entrelacé structure, qui offre une résistance mécanique élevée et une excellente ténacité, et peut inhiber efficacement la croissance des dendrites de lithium. et s'adapte bien à changements dans le volume de lithium, maintenant ainsi une forte interface Li/LGPS [Figure 3(c)]. En même temps, cette couche LiI présente une conductivité ionique élevée et certaine inertie chimique et présente une grande stabilité au lithium et au LGPS. Le La batterie Li/LiI/LGPS/S préparée a montré une capacité élevée de 1400 mA·h·g-1 à 0,1 C, et a montré un taux de rétention de capacité élevé de 80,6 % après 150 cycles dans une pièce température. Même dans des conditions difficiles de 1,35 mA·h·cm-1 et 90°C, il reste présente une capacité élevée de 1 500 mA·h·g-1 et une excellente stabilité pendant 100 cycles. Montrant son grand potentiel dans divers scénarios d’application. Basé sur la méthode de solution, Liang et al. synthétisé une couche Li x SiS y in situ sur le surface du lithium métallique comme SEI pour stabiliser l'interface Li/Li3PS4. Ce La couche Li x SiS y est stable à l'air et peut prévenir efficacement les réactions secondaires entre le lithium et le milieu environnant. Il peut être cyclé de manière stable pendant plus de 2000 heures dans une batterie symétrique. L'équipe a également signalé un stratégie de solution utilisant des composites polyacrylonitrile-soufre (PCE) comme ex situ SEI artificiel. Utilisation du PCE comme couche intermédiaire à l'interface entre Le lithium métal et le LGPS suppriment considérablement la réaction d'interface entre LGPS et Li métal. La batterie entièrement solide assemblée présente une valeur initiale élevée capacité. 148 mA·h·g-1 à un taux de 0,1 C. Il est de 131 mA·h·g-1 à un taux de 0,5 C. Le la capacité reste de 122 mA·h·g-1 après 120 cycles à un taux de 0,5 C. Démontrer excellentes performances.
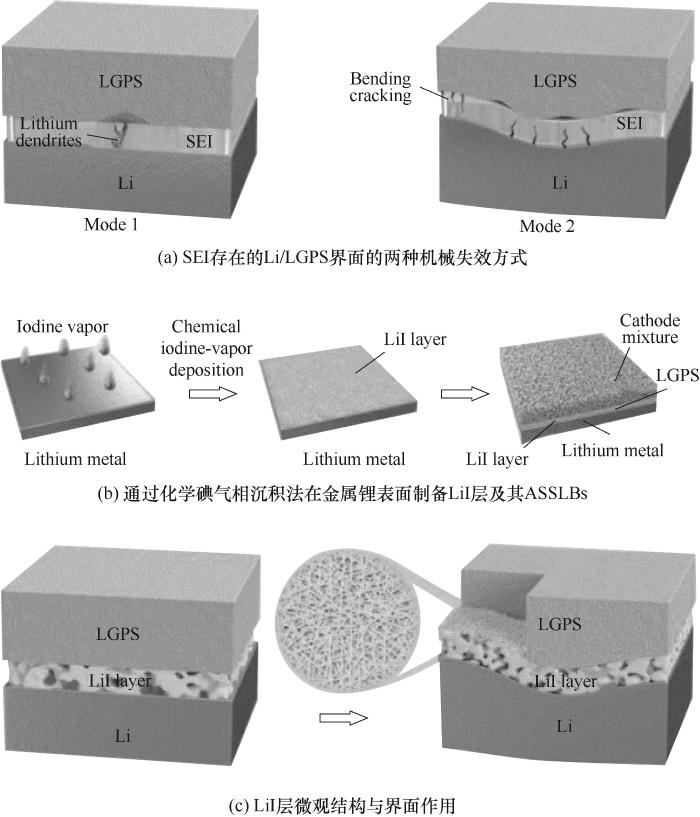
Fig.3 Schéma schématique de l'interface entre LGPS et Li anode
1.4.3 Optimisation de l'électrolyte
L'optimisation des électrolytes peut non seulement améliorer la conductivité ionique de l'électrolyte sulfure, mais également éviter ou réduire la réduction de l'électrolyte par l'anode de lithium à un certain étendue. Parmi eux, l'utilisation d'une substitution d'éléments appropriée est un moyen efficace stratégie pour améliorer la conductivité ionique et stabiliser l’interface anodique. Les expériences de Sun et al. montrer que le dopage à l'oxygène peut augmenter la conductivité ionique (Li10GeP2S11.7O0.3 : 8,43 × 10-2 S·cm-1 ; LGPS : 1,12 × 10-2 S·cm-1). En même temps temps, les réactions interfaciales sont évitées, améliorant ainsi la stabilité de l’interface électrolyte lithium/sulfure. En plus de l'oxygène, du sulfure métallique le dopage peut également réduire l'impédance de l'électrolyte lithium/sulfure interface. Par exemple, Li7P2.9S10.85Mo0.01 (vitrocéramique Li2S-P2S5 améliorée utilisant le dopage MoS2) présente une impédance d'interface inférieure à celle du L7P3S11. Li3.06P0.98Zn0.02S3.98O0.02 (ZnO dopé dans Li3PS4) montre également un bon cycle Stabilité (taux de rétention de capacité de 100 cycles de 81%, Li3PS4 nu n'est que de 35%). Bien que la substitution appropriée d'éléments ait donné de bons résultats pour le interface électrolyte lithium/sulfure. Cependant, ces méthodes de modification ont encore des problèmes tels que l'apparition de réactions secondaires et la formation des dendrites de lithium au cours de cycles longs. La limite supérieure du rôle de la cinétique sur les problèmes d'interface doit être confirmée davantage, et d'autres stratégies doivent être combinés pour améliorer la stabilité chimique du lithium/sulfure interface électrolytique. La conception de la structure de l'électrolyte peut également inhiber la apparition de réactions secondaires et empêche la nucléation et la croissance du lithium dendrites. Ye et al. a proposé une conception ingénieuse d'une structure en sandwich électrolyte [Figure 4 (a)]. Prendre en sandwich l'électrolyte instable entre plus les électrolytes stables évitent le contact direct grâce à une bonne décomposition locale dans la couche de l’électrolyte le moins stable. Cela peut à la fois empêcher la croissance de dendrites de lithium et combler les fissures générées. Cette expansion en forme de vis le concept de conception permet d'obtenir un cycle stable d'anode au lithium métallique associée à Cathode LiNi0.8Mn0.1Co0.1O2 [comme le montre la figure 4 (b), la capacité de rétention le taux est de 82 % après 10 000 cycles à 20 C ]. Plus important encore, ce travail n'est pas limité à des matériaux spécifiques. Des cycles stables peuvent être observés en utilisant LGPS, LSPSCl, Li9.54 Si1.74P0.94S11.7Cl0.3 (LSPS), Li3YCl6, etc. comme matériaux de couche centrale. Il fournit une méthode de conception hautement applicable pour améliorer la stabilité du interface anode de lithium/électrolyte sulfure.
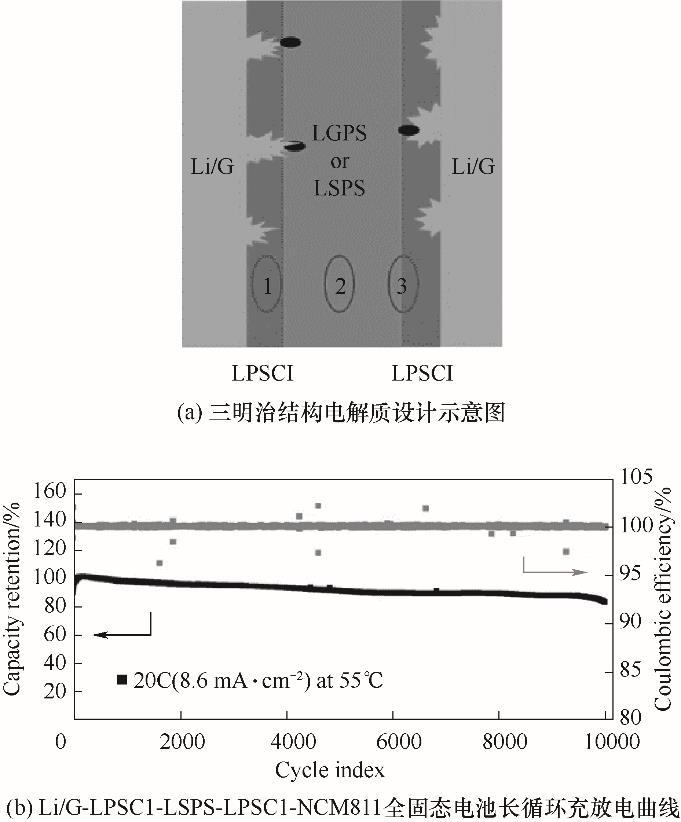
Fig.4 Schéma schématique de l'électrolyte à structure sandwich conception et courbe de performances électrochimiques à cycle long
1.4.4 Modification de l'anode au lithium
La modification de l'anode au lithium peut réduire ou éviter l'apparition de fissures d'électrolyte causées par le fluage comportement du lithium métallique pendant le cyclage, inhibant ainsi la formation de dendrites de lithium. Comme le montre la figure 5, Su et al. utilisé un film de graphite pour protéger l'électrode négative au lithium, séparer la couche d'électrolyte LGPS du lithium métallique et inhibe la décomposition du LGPS. Basé sur le mécanisme de retrait mécanique, une pression externe de 100 ~ 250 GPa est appliquée au système de batterie. Cette contrainte de force externe optimise l'interface contact entre les particules d'électrolyte et entre la couche d'électrolyte et le Anode Li/G. La batterie entièrement solide atteint d'excellentes performances de cycle. De plus, l’alliage du lithium métallique constitue également un moyen important de résoudre le problème. problème d'interface d'anode au lithium des batteries au lithium entièrement solides. Dans rapports actuels, les alliages de lithium ont montré certains avantages pour résoudre des problèmes tels que de graves réactions secondaires à l'interface et la génération de lithium dendrites dans les anodes de lithium, qui seront présentées en détail ci-dessous.

Fig.5 Conception de protection du film de graphite pour Li/LGPS interface
Inachevé, à suivre.