Activité électrochimique de l'électrode positive Matériau de la batterie sodium-ion P2-Nax[Mg0,33Mn0,67]O2
Auteur : ZHANG Xiaojun1, LI Jiale1,2, QIU Wujie2,3, YANG Miaosen1, LIU Jianjun2,3,4
1. Centre scientifique et technologique de la province de Jilin pour la conversion propre et l'utilisation à grande valeur de la biomasse, Université de l'énergie électrique du Nord-Est, Jilin 132012, Chine
2. Laboratoire clé d'État des céramiques hautes performances et de la microstructure superfine, Institut de céramique de Shanghai, Académie chinoise des sciences, Shanghai 200050, Chine
3. Centre de science des matériaux et d'ingénierie optoélectronique, Université de l'Académie chinoise des sciences, Pékin 100049, Chine
4. École de chimie et de science des matériaux, Institut d'études avancées de Hangzhou, Université de l'Académie chinoise des sciences, Hangzhou 310024, Chine
Résumé
Avec les avantages d'un faible coût et d'une large distribution de matières premières, Les batteries sodium-ion sont considérées comme les meilleurs matériaux alternatifs pour matériaux de cathode de batterie lithium-ion. Dans la phase P2, NaMnO2 avec des couches structure, une solution solide binaire de la couche de métal de transition peut efficacement améliorer les performances électrochimiques du matériau de l'électrode. Dans ce étude, le modèle structurel de Nax[Mg0.33Mn0.67]O2 avec l'ion Mg La solution solide a été construite en utilisant le modèle coulombien. Le les calculs des premiers principes ont révélé que la tension de décharge de Nax[Mg0.33Mn0.67]O2 atteignait 3,0 V à une teneur en ions sodium inférieure à 0,67. Densité électronique d'états et de charge l'analyse de la population a montré que la solution solide de Mg motivait l'activité anionique activité électrochimique de l'oxygène du réseau dans la phase P2 Nax[Mg0.33Mn0.67]O2, qui a transformé le mécanisme de réaction électrochimique du système à partir de cationique et anionique réaction redox synergique à réaction redox anionique réversible. Ce la transformation fournit une nouvelle méthode pour la conception de matériaux d'électrode pour les batteries Na-ion, ainsi qu'une nouvelle approche pour l'optimisation et exploration d’autres batteries ioniques.
Mots clés : batterie sodium-ion ; électrochimique activité ; premier principe ; dopage aux métaux alcalins
TOB NEW ENERGY fournit un ensemble complet de matériaux pour batterie, machine à batterie, solution de ligne de production de batterie et technologie de batterie pour batterie à semi-conducteurs, Fabrication de batteries sodium-ion et de batteries lithium-ion.
Berthelot et al.[10]ont constaté que dans l'oxyde en couches NaTMO2 contenant un seul métal de transition (TM), le sodium les ions et les lacunes sont ordonnés dans la couche de sodium pur, ce qui entraîne de nombreux plates-formes de tension pour ce type d'oxyde pendant le processus de décharge. . Ce entraîne une diminution rapide de la capacité spécifique et une réduction significative de performances de cycle, de sorte que l'efficacité de conversion d'énergie de ce type d'oxyde est faible. Des éléments de solution solide sont introduits dans la couche de métal de transition pour forment un arrangement mixte de métaux de transition binaires ou même multi-éléments. Le Le matériau de l'électrode contient un grand nombre de charges désordonnées, qui peuvent supprime efficacement la plate-forme de tension ci-dessus et améliore la conversion d'énergie efficacité. Yabuuchi et al.[11] ont utilisé Na2CO3, (MgCO3)4Mg(OH)2·5H2O et MnCO3 comme matières premières. Une réaction à l'état solide a été réalisée à 900°C pendant 12 heures pour obtenir une électrode Na2/3[Mg1/3Mn2/3]O2 en phase P2 désordonnée binaire matériau avec une solution solide de Mg. Ils ont constaté qu'à une densité de courant de 10 mA/g, la capacité spécifique initiale de la phase P2 préparée Le matériau de la cathode Na2/3[Mg1/3Mn2/3]O2 était d'environ 150 mAh/g[11]. Légèrement inférieure à la capacité spécifique de Na2/3MnO2 (184 mAh/g). Bruce et al.[12]ont découvert que même s'il y avait une réaction électrochimique du réseau d'oxygène dans la phase P2 Na2/3[Mg1/3Mn2/3]O2, aucune précipitation d'oxygène n'a été observé. Il montre que l’introduction du Mg améliore la réversibilité du cycle et capacité spécifique réversible du matériau. Cependant, pendant la charge et processus de décharge, le mécanisme de réaction électrochimique microscopique de l'oxygène du réseau dans ce système n'est pas encore clair, et le mécanisme par lequel La solution solide Mg améliore la stabilité du système n’est pas non plus claire.
Par conséquent, ce travail prend la phase P2 Nax[Mg0.33Mn0.67]O2 comme objet de recherche et adopte les premiers principes méthode de calcul de la théorie fonctionnelle de la densité (DFT). Une étude systématique sur l'activité électrochimique et la stabilité structurelle de la décharge performances du matériau cathodique Nax[Mg0.33Mn0.67]O2 avec une solution solide de Mg les ions ont été conduits. Afin de clarifier le mécanisme microscopique de l'électrode matériaux dans des réactions électrochimiques à l’échelle microscopique des électrons et atomes, il fournira une référence pour la compréhension des phénomènes électrochimiques procédés et la conception de nouveaux matériaux.
1 Méthode de calcul
Les calculs de ce travail sont basés sur le logiciel de base d'onde plane VASP [13,14] de densité théorie fonctionnelle. La méthode des ondes planes additives est utilisée[15], et la fonctionnelle de corrélation d'échange est l'approximation du gradient généralisé (GGA) sous la forme de Perdew-Burker-Ernzerhof[13,16]. Le Hubbard le paramètre U est introduit pour corriger les d électrons de Mn, et le U effectif la valeur est de 3,9 eV [17,18]. L'énergie de coupure de l'onde du plan inférieur est de 600 eV. Lorsque la relaxation des ions est terminée, les forces exercées sur tous les atomes sont moindres. que 0,1 eV·nm-1. Lors de l'optimisation de la structure cristalline, un 3Ã3Ã1 (72 atomes) La structure supercellulaire est utilisée, la constante de réseau est de 0,874 nm × 0,874 nm × 1,056 nm, et la grille de k points de la zone Brillouin est 3Ã3à 3[19]. Le La méthode des phonons gelés a été utilisée pour calculer le spectre de vibration du réseau dans le progiciel Phonopy. Afin d'éviter l'influence des périodiques conditions aux limites, une structure de supercellule 3 × 3 × 1 a été utilisée pour calculer la constantes de force et spectres de phonons de la phase P2 NaMnO2 et Na[Mg0.33Mn0.67]O2. Le modèle Coulomb de charge ponctuelle est utilisé pour calculer rapidement l'occupation ionique de la structure désodique et de la configuration d'occupation Na avec le plus bas L'énergie coulombienne est sélectionnée pour des calculs plus précis des premiers principes [20]. La tension de décharge du matériau de l'électrode peut être exprimée comme suit : [20] :
$V=-\frac{G(\text{N}{{\text{a}}_{{{x}_{2}}}}\text{M}{{\text{O} }_{2}})-G(\text{N}{{\text{a}}_{{{x}_ {1}}}}\text{M}{{\text{O}}_{2}})-({{x}_{2}}-{{x}_{1}})G(\ texte{Na})}{({{x}_{2}}-{{x}_{1}}){{e}^{-}}}$
Où G est l'énergie totale du système correspondant, et e- est la charge de l'élément[21].
2 Résultats et discussion
2.1 Caractéristiques microstructurales et stabilité structurelle
Le groupe spatial de la phase P2 NaMnO2 la structure est R$\bar{3}m (Fig. 1)[22,23]. La configuration spatiale de la solution solide Mg Na0.67[Mg0.33Mn0.67]O2 est similaire à celle de NaMnO2. Les ions Mg remplacent 1/3 des ions Mn dans la couche de métal de transition. Le le rapport ionique théorique de Mg à Mn est de 1:2. Caractérisation expérimentale trouvée qu'à ce rapport, les ions Mg dans la structure Nax[Mg0.33Mn0.67]O2 ne forment que arrangements désordonnés avec Mn, conservant l'ordre de la couche de Na[24]. Lorsque le rapport ionique Mg:Mn1:2, Mg, Na et Mn formeront un disposition des cations. Comme le montre la figure 1 (A), le mode d'empilement du réseau l'oxygène est ABBA..., Mg et Mn occupent respectivement les sites octaédriques entre les couches d'oxygène AB, et Na occupe les sites de prisme triangulaire entre les couches d'oxygène AA et BB [25,26]. Comme le montre la figure 1(B), il y a un agencement en nid d'abeilles de Mg et Mn dans la couche de métal de transition[27], ce qui est similaire à l’arrangement entre Li et Mn dans les composés riches en lithium[28]. L'octaèdre [MgO6] est disposé en 6 octaèdres [MnO6] partageant bords[29,30]. Dans la couche de métal alcalin du Structure Na0,67[Mg0,33Mn0,67]O2, il existe deux sites de réseau pour les ions sodium. L'une est disposée avec les couches supérieure et inférieure d'octaèdres [MgO6] ou [MnO6] partage des bords. L'autre est disposé de manière coplanaire avec les couches supérieure et inférieure de Octaèdres [MgO6] ou [MnO6].
![Fig. 1 Schematic diagram of P2-Na2/3[Mg1/3Mn2/3]O2 Fig. 1 Schematic diagram of P2-Na2/3[Mg1/3Mn2/3]O2](/js/htmledit/kindeditor/attached/20231108/20231108103040_37156.webp)
Fig. 1 Diagramme schématique de P2-Na2/3[Mg1/3Mn2/3]O2
Dans des structures avec différents ions sodium contenus, les ions sodium sont affectés par l’interaction coulombienne entre Mn et Mg dans la couche de métal de transition et des ions Na dans la couche de métal alcalin, montrant deux modes d'occupation différents. Par conséquent, ce travail utilise d’abord le Coulomb modèle pour filtrer rapidement la configuration Na0.67[Mg0.33Mn0.67]O2 de la phase P2 avec l'énergie coulombienne la plus basse. Afin de vérifier la rationalité, nous calculé et simulé les modèles XRD de ces configurations filtrées et les ont comparés aux résultats mesurés[11]. Les résultats sont affichés sur la figure 2. Les calculs (016) et (110) sont légèrement décalés vers la droite par rapport à la caractérisation expérimentale, qui est principalement due à la existence de structures amorphes et défectueuses dans certains plans cristallins du matériaux préparés expérimentalement. La structure du modèle informatique est une structure cristalline parfaite, il y a donc un certain écart entre le XRD l'élargissement et l'intensité maximale de la simulation informatique et la résultats expérimentaux. De plus, il existe un arrangement d’ions Na dans ces deux plans cristallins, et l'insertion et le détachement des ions Na en sont un autre raison possible du déplacement des positions des pics correspondants. Après compte tenu des effets ci-dessus, la forme et l'intensité du pic de la simulation Les XRD sont cohérentes avec les résultats expérimentaux et le modèle construit peut reproduire les informations microstructurales dans l'expérience, indiquant que la structure théoriquement filtrée est relativement précise et fiable[31,32].
![Fig. 2 Comparison of calculated and experimental XRD patterns of Na0.67[Mg0.33Mn0.67]O2 Fig. 2 Comparison of calculated and experimental XRD patterns of Na0.67[Mg0.33Mn0.67]O2](/js/htmledit/kindeditor/attached/20231108/20231108103050_54123.webp)
Fig. 2 Comparaison des DRX calculées et expérimentales modèles de Na0,67[Mg0,33Mn0,67]O2
Afin d'étudier l'effet du Mg solide solution sur la stabilité structurelle, nous avons utilisé les premiers principes combinés aux "méthode des phonons gelés" pour calculer les spectres de vibration du réseau de P2-NaMnO2 et P2-Na[Mg0,33Mn0,67]O2. Comme le montre la figure 3, l'onde du propriétaire n'a pas de fréquence imaginaire dans toute la zone Brillouin, ce qui indique que P2-Na[Mg0.33Mn0.67]O2 a une stabilité dynamique. En comparant les spectres de phonons de des deux matériaux, il a été constaté que le dopage au Mg ne modifiait pas de manière significative la plage de fréquences de vibration et a eu peu d’impact sur les vibrations du réseau. Le La structure dopée au magnésium a également montré une bonne stabilité dynamique. De plus, Bruce et al. préparé avec succès la phase P2 Na[Mg0.33Mn0.67]O2 avec une solution solide de Mg, ce qui a en outre démontré que le matériau possède des propriétés thermodynamiques supplémentaires stabilité. Par conséquent, il n’est pas difficile de voir que P2-Na[Mg0.33Mn0.67]O2 a bonne stabilité structurelle.
![Fig. 3 Phonon dispersion curves of (A) NaMnO2 and (B) Na0.67[Mg0.33Mn0.67]O2 Fig. 3 Phonon dispersion curves of (A) NaMnO2 and (B) Na0.67[Mg0.33Mn0.67]O2](/js/htmledit/kindeditor/attached/20231108/20231108103102_42296.webp)
Fig. 3 Courbes de dispersion des phonons de (A) NaMnO2 et (B) Na0,67[Mg0,33Mn0,67]O2
2.2 Analyse des propriétés électrochimiques de la phase P2 Nax[Mg1/3Mn2/3]O2
Afin d'étudier l'effet du dopage au Mg sur les propriétés électrochimiques des matériaux, nous avons calculé la décharge tension de la structure de la solution solide de Mg P2-Nax[Mg0,33Mn0,67]O2 (Figure 4). Le La plage de concentration des ions Na est déterminée expérimentalement, c'est-à-dire 0,11â¤xâ¤0,66[11].La figure 4(A) montre les changements structurels au cours de la processus de décharge, et sa tension correspondante (Figure 4 (B)) comprend principalement trois plateformes : 3,4, 2,9 et 2,1 V. La capacité théorique prévue est de 152 mAh/g, ce qui est fondamentalement cohérent avec les résultats expérimentaux[11]. La courbe de tension de décharge calculée à partir des premiers principes est légèrement supérieur au résultat réellement mesuré. La raison principale est que la première le calcul des principes ignore l'influence des mesures expérimentales Conditions, telles que l'électrolyte, la conductivité des ions lithium expérimentale température de mesure, etc. Nos recherches précédentes ont montré[33]que bien que la courbe de tension de décharge calculée soit supérieure à la Courbe mesurée expérimentalement, la tendance globale du changement est cohérente. On peut donc considérer que pendant tout le processus de déchargement, le la tension de Nax [Mg0,33Mn0,67] O2 est cohérente avec les résultats expérimentaux [12,20]. Lorsque x < 66 %, Nax[Mg0,33Mn0,67]O2 a une haute tension d'environ 3,0 V, et il n'y a pas de plate-forme de tension supplémentaire évidente, indiquant que la substitution de Mg2+ par Mn3+ a pour effet d'inhiber le réarrangement des ions sodium et changement de phase structurelle. Des études antérieures de charge et de décharge sur NaMnO2 et d'autres systèmes ont montré que la disposition ordonnée des métaux de transition s'accompagne généralement de davantage de plates-formes de tension.
![Fig. 4 (A) DFT-calculated structural changes and (B) discharge voltage curve of P2-Nax[Mg0.33Mn0.67]O2 during discharge Fig. 4 (A) DFT-calculated structural changes and (B) discharge voltage curve of P2-Nax[Mg0.33Mn0.67]O2 during discharge](/js/htmledit/kindeditor/attached/20231108/20231108103110_90088.webp)
Fig. 4 (A) Modifications structurelles calculées par DFT et (B) courbe de tension de décharge de P2-Nax[Mg0.33Mn0.67]O2 pendant la décharge
Dans des circonstances idéales, la valence les états de Mg et Mn dans Na2/3[Mg0.33Mn0.67]O2 sont respectivement +2 et +4, et ne peut pas continuer à être oxydé vers des états de valence plus élevés. Il n’y a donc pas activité électrochimique des cations dans le système, ainsi que la charge et la décharge Le processus du matériau est une réaction électrochimique anionique. Dans Na0,67MnO2, l'état de valence initial des ions Mn est de +3,33. Pendant le processus de charge, Mn les ions peuvent transférer 0,67 électrons vers l’extérieur pour atteindre une valence stable de +4. À cette fois, tout Na+ a été libéré, et l'oxygène du réseau n'a jamais été libéré. participé à la réaction électrochimique[34]. Par conséquent, le Le processus de charge et de décharge de Na0,67MnO2 apparaît comme un cationique réaction électrochimique. De nombreuses études ont montré que lorsque le nombre de Les électrons perdus par l'oxygène du réseau sont inférieurs à 0,33, l'électrochimique anionique la réaction a une bonne réversibilité [11-12,28]. L'oxydation excessive d'anions oxygène (le nombre d'électrons perdus est supérieur à 0,33) provoque la configuration électronique de l'oxygène pour s'écarter du strègle à huit coupleurs capable, entraînant une réaction de transformation irréversible et la formation d'un Liaison O-O. Cela peut même conduire à un dégagement d'oxygène et à une charge irréversible et décharge de la structure de l'électrode [27,35]. Dans Na0,67[Mg0,33Mn0,67]O2, si l'on considère l'état limite de perte de charge. Que c'est-à-dire lorsque les ions Na sont complètement détachés pour former le Na0[Mg0.33Mn0.67]O2 structure, Mg et Mn conservent toujours des valences +2 et +4. L'anion O est oxydé à -1,67 valence, perdant 0,33 électrons, ce qui est inférieur à la limite de réaction électrochimique anionique irréversible. Par conséquent, dans l'ensemble créaction de charge de Na0,67[Mg0,33Mn0,67]O2, l'oxygène du réseau n'a pas besoin être réorganisé spatialement et la réaction électrochimique est réversible. L'introduction de Mg2+ maintient non seulement la capacité spécifique réversible, mais augmente également la densité énergétique du matériau en augmentant la tension de décharge.
Afin de prouver l’électrochimie activité de l'oxygène dans le matériau Nax[Mg0.33Mn0.67]O2 lors de la décharge processus, nous avons calculé la densité électronique des états (Figure 5) pour le structures de décharge initiale et finale du matériau. On a constaté que pendant le processus de décharge, les ions Na ont été progressivement incorporés, le nombre total d'électrons dans le système a augmenté et le niveau de Fermi est passé à un niveau plus élevé. niveau d'énergie. Le nombre de trous sur l’orbite O2p diminue progressivement, indiquant que les électrons entrant dans le système sont transférés vers le vide orbites de l'oxygène du réseau, et l'oxygène du réseau est réduit. Pendant le Processus de décharge du matériau de l'électrode, l'oxygène du réseau participe à la réaction électrochimique des anions. Pour l’instant, il n’y a presque aucun changement dans les électrons orbitaux Mn-d, et il n'y a pas de transfert de charge, c'est-à-dire que le l'état de valence de Mn ne change pas pendant le processus de décharge, ce qui prouve que Le Mn n'est pas électrochimiquement actif [12,36]. Cependant, pendant la processus de décharge de P2-NaxMnO2, les électrons continuent de remplir le Mn à haute énergie et O orbitales vides, indiquant que Mn et O sont électrochimiquement actifs et constituent une réaction électrochimique typique dans laquelle les anions et les cations coopèrent.
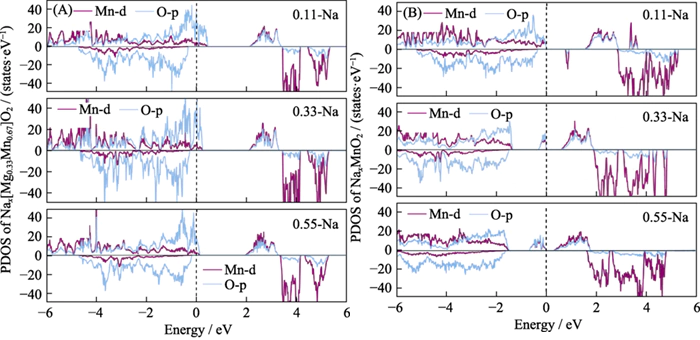
Fig. 5 Densité électronique des états de (A) P2-Nax[Mg0.33Mn0.67]O2 et (B) P2-NaxMnO2 sous différents ions Na contenu pendant la décharge
PDOS : projeté densité d'états
Une conclusion cohérente peut être tirée grâce à une analyse de la population de charges (Figure 6). Pendant le processus de décharge de Nax[Mg0.33Mn0.67]O2, la quantité de charge des ions Mn ne change fondamentalement pas, donc il ne participe pas à la réaction électrochimique ; en cours de en augmentant la teneur en Na de 0,11 à 0,66, les ions O ont obtenu environ 0,2e- . Un remplissage de charge important s'est produit, montrant une activité électrochimique anionique [37]. Grâce à l'analyse de la population de charges de P2-NaxMnO2, il a été constaté qu'à mesure que la teneur en Na augmente, Mn et O participent conjointement à la réaction électrochimique. Ce résultat est cohérent avec l’analyse de densité électronique des États. Il est prouvé que la solution solide de Mg modifie le mécanisme de réaction électrochimique du système de l'anion et réaction électrochimique coopérative de cations avec un anion réversible réaction électrochimique, et ce processus n'affecte pas la charge et réversibilité de décharge du matériau.
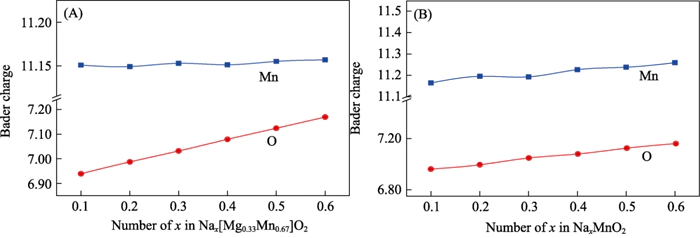
Fig. 6 Charger analyse de (A) Nax[Mg0.33Mn0.67]O2 et (B) P2-NaxMnO2 sous différents ions sodium contenu
3 Conclusion
Cette étude a utilisé les premiers principes des calculs pour étudier systématiquement les caractéristiques microstructurales, stabilité cinétique et activité électrochimique de la solution solide Mg2+ P2 phase Nax[Mg1/3Mn2/3]O2. L'introduction de Mg2+ modifie le comportement électrochimique type de réaction du matériau issu de la coopérative anionique et cationique réaction électrochimique de NaxMnO2 à la réaction électrochimique anionique réversible réaction de Nax[Mg0.33Mn0.67]O2. Lorsque l'anion O dans P2-Nax[Mg0.33Mn0.67]O2 participe à la réaction électrochimique, la plage de gain et de perte de charge est inférieur à 0,33, ce qui présente une bonne réversibilité. L’introduction du Mg2+ non seulement augmente la tension de décharge du matériau, mais maintient également la capacité spécifique réversible du matériau, et augmente finalement la densité énergétique du matériau.
Dans les matériaux d'électrodes à ions sodium, introduire des métaux alcalino-terreux dans la transition metal couche pour cationique La solution solide est une nouvelle stratégie d’optimisation des performances des matériaux. C'est basique Le mécanisme consiste à déclencher l’activité électrochimique des anions en sacrifiant l'activité électrochimique des cations, modifiant la réaction électrochimique mécanisme du matériau, augmentant la tension de décharge, et finalement optimiser la densité énergétique du matériau. Cette stratégie fournit non seulement une nouvelle méthode de conception de matériaux d'électrodes pour batteries sodium-ion, mais fournit également de nouvelles idées pour l'optimisation et l'exploration d'autres ions piles.
Références
[1] HU YING-YING, WEN ZHAO-YIN, RUI-KUN, et al. État de l'art état de recherche et développement des batteries au sodium. Stockage d'énergie Science et technologie, 2013,2(2):81-90.
[2] SHEN GUAN-YE, LI CHEN, XU BING-LIANG, et al. Allocation économique pour un système de stockage d’énergie prenant en compte l’énergie éolienne. Journal du Nord-Est Université de l'énergie électrique, 2018,38(4):27-34.
[3] MA CHAO, ZHAO XIAO-LIN, KANG LI-TAO, et al. Non conjugué matériaux d'anode dicarboxylate pour cellules électrochimiques. Angew. Chimique. Int. Éd., 2018,57(29):8865-8870.
[4] RICHARDS W D, DACEK S T, KITCHAEV D A, et al. Fluoration de matériaux de cathode d'oxyde de métal de transition en excès de lithium. Énergie avancée Matériaux, 2018,8(5):1701533.
[5] XIANG XING-DE, ZHANG KAI, CHEN JUN. Les progrès récents et perspectives des matériaux cathodiques pour les batteries sodium-ion. Av. Mater., 2015,27(36):5343-5364.
[6] MA CHAO, ZHAO XIAO-LIN, HARRIS M M, et coll. L'acide urique comme composé électrochimiquement actif pour les batteries sodium-ion : mécanismes de stockage Na+ par étapes de Ï-conjugaison et d'anion carbone stabilisé. Matériaux appliqués ACS & Interfaces, 2017,9(39):33934-33940.
[7] LIE D H, XU JING, MENG Y S. Une cathode avancée pour batteries Na-ion avec un débit élevé et une excellente stabilité structurelle. Phys. Chimique. Chimique. Phys., 2013,15(9):3304-3312.
[8] KUBOTA K, YABUUCHI N, YOSHIDA H, et al. Oxydes en couches comme matériaux d'électrode positive pour batteries Na-ion. Bulletin MRS, 2014,39(5):416-422.
[9] CLÉMENT R J, BRUCE P G, GREY C P. Reviewâmanganèse- à base d'oxydes de métaux de transition de type P2 comme matériaux cathodiques de batterie sodium-ion. Journal de la Société électrochimique, 2015,162(14):A2589-A2604.
[10] BERTHELOT R, CARLIER D, DELMAS C. Électrochimique étude du diagramme de phase P2-NaxCoO2. Nat. Mater., 2011,10(1):74-80.
[11] YABUUCHI N, HARA R, KUBOTA K, et al. Une nouvelle électrode matériau pour les batteries rechargeables au sodium : Na2/3[Mg0,28Mn0,72]O2 de type P2 avec une teneur anormalement élevée capacité réversible. J. Mater. Chimique. A, 2014,2(40):16851-16855.
[12] MAITRA U, MAISON R A, SOMERVILLE J W, et al. Rédox de l'oxygène chimie sans excès d’ions alcalins dans Na2/3[Mg0.28Mn0.72]O2. Nat. Chem., 2018,10(3):288-295.
[13] GUO SHAO-HUA, SUN YANG, YI JIN, et al. Compréhension Diffusion des ions sodium dans les oxydes en couches P2 et P3 via des expériences et calculs de principes premiers : un pont entre la structure cristalline et performances électrochimiques. NPG Asia Materials, 2016,8:e266.
[14] JI HUI-WEI, KITCHAEV D A, LUN ZHANG-YAN, et al. Informatique étude et réalisation expérimentale de Li-ion désordonné à haute capacité cathodes à base de Ni redox. Chimie de Matériaux, 2019,31(7):2431-2442.
[15] LEE J, URBAN A, LI XIN, et al. Déverrouillage du potentiel d'oxydes désordonnés en cations pour les batteries au lithium rechargeables. Science, 2014,343(6170):519-522.
[16] URBAN A, LEE J, CEDER G. La configuration espace d'oxydes de type sel gemme pour électrodes de batterie au lithium haute capacité. Énergie avancée Matériaux, 2014,4(13):1400478.
[17] CHAKRABORTY A, DIXIT M, AURBACH D, et al. Prédire avec précision propriétés cathodiques des matériaux d'oxyde en couches utilisant la densité méta-GGA SCAN fonctionnel. npj informatique Matériaux, 2018,4:60.
[18] URBAN A, ABDELLAHI A, DACEK S, et al. Structure électronique origine du désordre cationique dans les oxydes de métaux de transition. Phys. Rev. Lett., 2017,119(17):176402.
[19] ASSAT G, TARASCON J M. Fondamental compréhension et défis pratiques de l'activité redox anionique dans le Li-ion piles. Énergie naturelle, 2018,3(5):373-386.
[20] YABUUCHI N, NAKAYAMA M, TAKEUCHI M, et al. Origine de stabilisation et déstabilisation dans une réaction redox à l'état solide d'ions oxyde pour les batteries lithium-ion. Nat. Commun., 2016,7:13814.
[21] SANNYAL A, AHN Y, JANG J. Premiers principes étude sur le siligène bidimensionnel (SiGe 2D) comme matériau anodique d'un batterie aux ions de métal alcalin. Informatique Science des matériaux, 2019,165 : 121-128.
[22] LI HONG, HU YONG-SHENG, PAN HUI-LIN, et al. Les progrès de la recherche sur structure matérielle de l'électrode de la batterie de stockage sodium-ion à température ambiante. Scientia Sinica Chimica, 2014,44(8):1269-1279.
[23] WANG YUE-SHENG, XIAO RUI-JUAN, HU YONG-SHENG, et al. Électrode désordonnée par les cations P2-Na0.6[Cr0.6Ti0.4]O2 pour les batteries sodium-ion rechargeables symétriques à haut débit. Nat. Commun., 2015,6:6954.
[24] WANG QIN-CHAO, MENG JING-KE, YUE XIN-YANG, et al. Réglage structuré en P2 matériau de cathode par substitution Na-site Mg pour les batteries Na-ion. Confiture. Chimique. Soc., 2019,141(2):840-848.
[25] MENDIBOURD A, DELMAS C, HAGENMULLER C. Électrochimique intercalation et désintercalation des bronzes NaxMnO2. Presse académique, 1985,57(3):323-331.
[26] SOMERVILLE J W, SOBKOWIAK A, TAPIA-RUIZ N, et al. Nature du Phase « Z » dans des cathodes de batterie Na-ion en couches. Énergie & Sciences de l'environnement, 2019,12(7):2223-2232.
[27] QU JIE, WANG DONG, YANG ZU-GUANG, et al. Dopage ionique ajustement de la cathode composite induit par la variation du site : une étude de cas de tunnel de couches Na0,6MnO2 avec dopage Mg2+ sur le site Na/Mn. Application ACS. Maître. Interfaces, 2019,11(30):26938-26945.
[28] SATO T, SATO K, ZHAO WEN-WEN, et al. Métastable et Oxydes de type sel gemme désordonnés par les cations de taille nanométrique : revisite de la stoechiométrique LiMnO2 et NaMnO2. Journal des matériaux Chimie A, 2018,6(28):13943-13951.
[29] GUIGNARD M, DELMAS C. Utiliser une batterie pour synthétiser de nouveaux oxydes de vanadium. Sélection de chimie, 2017,2(20):5800-5804.
[30] WANG PENG-FEI, YAO HU-RONG, LIU XIN-YU, , et coll. Le désordre Na+/vacance promet des batteries Na-ion à haut débit. Science Advances, 2018, 4(3) : eaar6018.
[31] KIM H, KIM D J, SEO D H, et al. Etude ab initio de l'intercalation du sodium et des phases intermédiaires dans Na0,44MnO2 pour batterie sodium-ion. Chimie de Matériaux, 2012,24(6):1205-1211.
[32] LI XIN, MA XIAO-HUA, SU DONG, et al. Visualisation directe de l'effet Jahn-Teller couplé à l'ordre Na en Na5/8MnO2. Nat. Mater., 2014,13(6):586-592.
[33] WANG YOUWEI, WANG JUNKAI, ZHAO XIAOLIN, et al. Réduire la charge surpotentiel des batteries Li-O2 grâce à la conception de cathodes à alignement de bande. Énergie & Sciences de l'environnement, 2020,13(8):2540-2548.
[34] ZHENG C, RADHAKRISHNAN B, CHU I H, et al. Effets de mélange de métaux de transition sur l'ordre Na et la cinétique des oxydes P2 incrustés. Examen physique Appliqué, 2017,7(6):064003.
[35] LUN ZHENG-YAN, OUYANG B, CAI ZI-JIAN, et al. Principes de conception pour cathodes de sel gemme désordonnées en cations à base de Mn de haute capacité. Chem, 2020,6(1):153-168.
[36] Référencement D H, LEE J, URBAN A, et al. La structure et origine chimique de l'activité rédox de l'oxygène dans les couches et les cations désordonnés Matériaux cathodiques en excès de Li. Nat. Chem., 2016,8(7):692-697.
[37] BAI QIANG, YANG LU-FENG, CHEN HAI-LONG, et al. Études informatiques des matériaux d'électrode dans les batteries sodium-ion. Énergie avancée Matériaux, 2018,8(17):1702998.