WANG Kunpeng,1, LIU Zhaolin2, LIN Cunsheng2, WANG Zhiyu,1,2
1. Laboratoire clé d'État de chimie fine, École de génie chimique, Université de technologie de Dalian, Dalian 116024, Chine
2. Branche de développement de nouveaux matériaux, Valiant Co., Ltd., Yantai 265503, Chine
Résumé
Par rapport aux batteries Li-ion, les batteries Na-ion offrent les avantages d'un faible coût, de bonnes performances à basse température et de sécurité, attirant une grande attention dans les applications sensibles au coût et à la fiabilité. Avec une capacité élevée et un faible coût, les matériaux de type bleu de Prusse (PBA) constituent des matériaux cathodiques prometteurs pour les batteries Na-ion. Cependant, la présence d’eau cristalline dans leur structure induit une dégradation rapide des performances de la batterie, constituant un goulot d’étranglement critique limitant leur application. Ce travail présente une stratégie de traitement thermique simple pour éliminer efficacement l'eau cristalline des matériaux cathodiques PBA, améliorant ainsi la rétention de capacité de 73 % à 88 % après 340 cycles. L'analyse in situ révèle que la perte initiale de l'efficacité coulombienne de la cathode du PBA est le résultat de sa transformation irréversible d'une forme trigonale à une phase cubique pendant le processus de charge et de décharge. Ce problème peut être résolu en introduisant du Na2C2O4 pour compenser la perte irréversible de Na dans la cathode. Sur cette base, une batterie Na-ion quasi-solide haute performance est construite en associant une cathode PBA à faible teneur en eau avec un additif Na2C2O4 et une anode en carbone dur (HC) dans un diacrylate de polyéthylène glycol (PEGDA). )électrolyte quasi-solide à base de conductivité ionique et de stabilité électrochimique élevées. Cette batterie présente des capacités spécifiques allant de 58 à 105 mAh·g-1 à des densités de courant de 20 à 500 mA·g-1, capables de maintenir un cycle stable pendant plus de 200 cycles. Cette étude souligne l'amélioration significative de la stabilité et de la capacité des matériaux cathodiques PBA grâce à l'élimination efficace de l'eau cristalline qu'ils contiennent.Mots clés : batterie Na-ion ; batterie quasi-solide; Cathode bleue de Prusse ; analyse in situ
Le développement d'une technologie de batteries haute performance constitue un besoin stratégique majeur pour la Chine afin de transformer et de moderniser sa structure énergétique, de promouvoir une économie propre à faible intensité de carbone et d'atteindre l'objectif de « neutralité carbone et pic de carbone ». Les batteries lithium-ion sont l’un des systèmes de batteries à haut rendement les plus utilisés. Cependant, l'abondance de lithium dans la croûte terrestre n'est que de 0,0065 %, les réserves de lithium de la Chine ne représentent que 7 % du total mondial et près de 70 % du carbonate de lithium est importé. Il sera difficile à l’avenir de répondre à l’énorme demande dans le domaine du stockage d’énergie et des batteries de puissance. L'abondance du sodium dans la croûte terrestre est plus de 400 fois supérieure à celle du lithium. Les réserves chinoises de sodium représentent environ 22 % des réserves mondiales totales. Du point de vue du coût des matières premières, le coût des batteries sodium-ion peut être réduit de 30 à 40 % par rapport aux batteries lithium-ion. De plus, par rapport aux batteries lithium-ion, les batteries sodium-ion ont de meilleures performances à basse température, une plage de températures de fonctionnement plus large et une sécurité plus élevée. Ces avantages uniques en ont fait un centre d'attention dans les applications de stockage d'énergie sensibles aux coûts et critiques pour la sécurité [1].
Poussée par l'objectif du « double carbone », la demande de la Chine en matière de stockage d'énergie et de batteries électriques a atteint 158,5 GWh en 2020, et la demande mondiale de batteries devrait entrer dans l'ère du TWh en 2025. Avec les progrès de la technologie des batteries, la densité énergétique de Les batteries ont augmenté rapidement et les exigences en matière de sécurité des batteries sont devenues de plus en plus importantes. Les batteries lithium-ion traditionnelles utilisent des électrolytes organiques liquides sujets aux fuites, ce qui réduit la fiabilité de la batterie [2-3]. L'utilisation de batteries à semi-conducteurs avec une stabilité thermoélectrique élevée, une résistance mécanique élevée et aucun risque de fuite est une direction réalisable pour résoudre le problème de fiabilité [4-5], mais elle présente des problèmes tels qu'une densité élevée d'électrolytes solides, une faible conductivité ionique. , et un mauvais contact avec l'interface « solide-solide » des électrodes [6]. Les électrolytes quasi solides entre liquide et solide ont une meilleure stabilité et sécurité que les électrolytes liquides, et sont supérieurs aux électrolytes solides en termes de conductivité ionique, de flexibilité et de compatibilité d'interface [7â-9]. Ces avantages font des batteries quasi-solides basées sur celles-ci l’une des orientations les plus réalisables dans le domaine de la technologie avancée des batteries.
Les composés bleus de Prusse (PBA) sont actuellement les matériaux cathodiques les plus populaires pour les batteries sodium-ion. Leur structure à squelette ouvert et leurs nombreux sites de stockage de sodium leur confèrent une capacité spécifique théorique élevée (170 mAh g-1) et de bonnes performances de transport d'ions [10-11]. Dans les batteries à semi-conducteurs, les PBA peuvent être utilisés non seulement comme matériaux cathodiques mais également comme électrolytes solides [12-13]. Cependant, les PBA sont généralement préparés par précipitation de solution, ce qui formera des défauts de lacune Fe(CN)64 et une grande quantité d'eau cristalline dans leur structure, empêchant l'incorporation de Na+ dans le réseau des PBA et limitant leur capacité de stockage du sodium. De plus, l'eau cristalline contenue dans les PBA se libérera progressivement dans l'électrolyte pendant la réaction de la batterie, entraînant une dégradation rapide des performances de la batterie, des réactions secondaires, des flatulences et d'autres problèmes [11,14]. Ces problèmes limitent l’application des PBA dans les batteries à semi-conducteurs et rendent difficile leur correspondance avec la plupart des électrolytes solides inorganiques sensibles à l’eau. La formation de défauts de lacune et d'eau cristalline dans les PBA peut être efficacement inhibée par des stratégies telles que le traitement hydrothermal[15], la coprécipitation lente[16], l'inhibition de l'oxydation du Fe2+[17], la gravure chimique[18] et le dopage d'éléments[19- 20]. Cependant, les processus techniques concernés sont complexes et difficiles à contrôler avec précision, et les performances des cathodes PBA obtenues doivent également être améliorées. Compte tenu des problèmes ci-dessus, cette étude propose une méthode de traitement thermique simple et efficace pour réduire la teneur en eau cristalline des PBA et améliorer leur stabilité au stockage du sodium. Grâce à la technologie de polymérisation in situ, un électrolyte solide de référence en diacrylate de polyéthylène glycol (PEGDA) doté d'une conductivité ionique élevée et d'une stabilité électrochimique élevée a été développé. Sur cette base, la cathode PBA à faible teneur en eau et l'anode en carbone dur (HC) ont été adaptées dans l'électrolyte solide de référence PEGDA, et du Na2C2O4 a été ajouté à la cathode en tant que compensateur de sodium auto-sacrificiel pour construire un quasi- batterie sodium-ion à semi-conducteurs. Le mécanisme dynamique de stockage du sodium de la cathode PBA et de l'anode HC a été révélé par la technologie d'analyse in situ.
1 Méthode expérimentale
1.1 Préparation de la cathode de PBA à faible teneur en eau
116 mmol de citrate de sodium et 24 mmol de FeSO4·7H2O ont été dissous dans 400 ml d'eau désionisée désoxygénée. 116 mmol de citrate de sodium et 26 mmol de Na4Fe(CN)6 ont été dissous dans 400 ml d'eau désionisée désoxygénée. La solution contenant FeSO4 a été ajoutée lentement à la solution contenant Na4Fe(CN)6 et la réaction a été agitée à température constante pendant 6 h. Le produit a été lavé trois fois par centrifugation avec de l'éthanol et de l'eau déionisée désoxygénée, et séché sous vide à 120 °C pendant 24 h pour obtenir des PBA à haute teneur en eau cristalline (Hw-PBA). Il a été placé dans un four tubulaire protégé par de l'argon et calciné à 270 °C pendant 2 h pour obtenir des PBA à faible teneur en eau (Lw-PBA), avec une vitesse de chauffage de 0,5 °C · min-1.
1.2 Caractérisation des échantillons
La morphologie et la structure de l'échantillon ont été analysées à l'aide d'un microscope électronique à balayage à émission de champ. La composition chimique de l'échantillon a été analysée à l'aide d'un spectromètre photoélectronique à rayons X et d'un spectromètre d'émission à plasma à couplage inductif. La batterie a été analysée in situ à l’aide d’un diffractomètre à rayons X sur poudre et d’une spectroscopie Raman laser. La teneur en eau des cristaux de l'échantillon a été analysée à l'aide d'un analyseur thermogravimétrique dans une atmosphère d'argon à une vitesse de chauffage de 10 â·min-1.
1.3 Assemblage de la batterie et tests de performances électrochimiques
1.3.1 Ensemble demi-batterie à ions sodium liquide
Les piles bouton CR2016 ont été assemblées pour les tests. Le matériau de cathode bleu de Prusse (Hw-PBA ou Lw-PBA), le liant noir de Ketjen (KB) et le fluorure de polyvinylidène (PVDF) ont été uniformément mélangés dans un rapport massique de 8:1:1, de la N-méthylpyrrolidone (NMP) a été ajoutée en tant que solvant et dispersant, et la suspension résultante a été uniformément enduite sur une feuille d'aluminium recouverte de carbone comme cathode, avec une charge de matière active de 3~4 mg·cm-2. Des feuilles de sodium métallique ont été utilisées comme contre-électrodes et électrodes de référence. L'électrolyte était une solution DMC/EC (DMC : carbonate de diméthyle, EC : carbonate d'éthylène, rapport volumique 1:1) de 1,0 mol·L-1 NaClO4 et 5,0 % de carbonate de fluoroéthylène (FEC). La batterie a été assemblée dans une boîte à gants remplie d'argon (teneur en eau <10-7, teneur en oxygène <10-7).
1.3.2 Ensemble batterie complète à ions sodium liquide
L'électrode positive a été préparée en utilisant la méthode ci-dessus, HC a été utilisé comme électrode négative et le rapport N/P des électrodes positives et négatives a été contrôlé entre 1,1 et 1,2. La batterie a été assemblée dans une boîte à gants remplie d'argon (teneur en eau <10-7, teneur en oxygène <10-7) en utilisant l'électrolyte ci-dessus.
1.3.3 Préparation d'électrolyte quasi-solide
Le PEGDA a été mélangé à l'électrolyte liquide ci-dessus dans un rapport massique de 7:93. 5,0% d'azobisisobutyronitrile (AIBN) ont été ajoutés comme initiateur de polymérisation pour former une solution précurseur d'électrolyte quasi solide. Cette solution a été chauffée à 60 °C pendant 10 h pour former un électrolyte quasi solide.
1.3.4 Assemblage d'une batterie complète sodium-ion quasi-solide
Le matériau de l'électrode positive, le supplément de sodium Na2C2O4, l'agent conducteur KB et le liant PVDF ont été uniformément mélangés dans un rapport massique de 6,4 : 1,6 : 1,0 : 1,0, du NMP a été ajouté comme solvant et dispersant, et la suspension obtenue a été uniformément enduite sur un support en carbone. -une feuille d'aluminium enduite comme électrode positive, avec une charge de matière active de 3 à 4 mg·cm-2. HC a été utilisé comme électrode négative et le rapport N/P des électrodes positive et négative a été contrôlé entre 1,1 et 1,2. La solution précurseur de l'électrolyte quasi solide a été ajoutée à la batterie, et une fois la batterie encapsulée, elle a été chauffée à 60 °C pendant 10 h pour obtenir une batterie quasi solide. La batterie a été assemblée dans une boîte à gants remplie d'argon (teneur en eau <10-7, teneur en oxygène <10-7).
1.3.5 Test de performances de la batterie
La conductivité ionique de l'électrolyte quasi solide a été testée par spectroscopie d'impédance électrochimique (EIS) à l'aide d'un poste de travail électrochimique. La plage de fréquences de test était de 1 Hz à 1 000 kHz et l'amplitude de la tension de perturbation était de 5,0 mV. La fenêtre de stabilité électrochimique de l'électrolyte quasi solide a été testée par voltammétrie à balayage linéaire (LSV) avec un taux de balayage de 5 mV · s-1. Les performances du matériau et de la batterie ont été étudiées par la méthode de charge et de décharge à courant constant à l'aide d'un testeur de batterie Land CT2001A. La fenêtre de tension de la demi-cellule était de 2,0 à 3,8 V (par rapport à Na/Na+), la fenêtre de tension de la cellule entière était de 1,5 à 3,8 V et la densité de courant était de 10 à 500 mA·g-1. Lors du test de stabilité du cycle, la batterie a d'abord été cyclée 5 fois à une densité de courant de 50 mA·g-1, puis le test de stabilité du cycle a été effectué à différentes densités de courant.
2 Résultats et discussion
2.1 Analyse de la morphologie et de la composition
La courbe TGA des Hw-PBA sur la figure 1(a) montre deux régions de perte de poids rapide : 1) température ambiante jusqu'à 270 °C, 2) 440 à 580 °C. Dans la première région, la perte de poids depuis la température ambiante jusqu'à 120 °C (fraction massique 3,1 %) est provoquée par l'élimination de l'eau adsorbée ; la perte de poids de 120 à 200 °C (fraction massique 6,10 %) est provoquée par l'élimination de l'eau interstitielle dans la structure du PBA ; la perte de poids de 200 à 270°C (fraction massique 6,89%) correspond à l'élimination de l'eau cristallisée dans les PBA. Par conséquent, un traitement thermique à 270 °C a été choisi pour éliminer l’eau des Hw-PBA. Après traitement thermique à cette température, les Lw-PBA obtenus n'ont perdu qu'environ 1,18 % de leur poids à température ambiante ~ 270 °C, ce qui était 92,67 % inférieur à celui des Hw-PBA ; et ont perdu environ 0,74 % de leur poids à 200~270 °C, soit 89,26 % de moins que celui des Hw-PBA. Les résultats ci-dessus montrent que le traitement thermique peut éliminer efficacement différents types d'eau dans les PBA, et que les PBA à faible teneur en eau obtenus ont une bonne stabilité thermique.
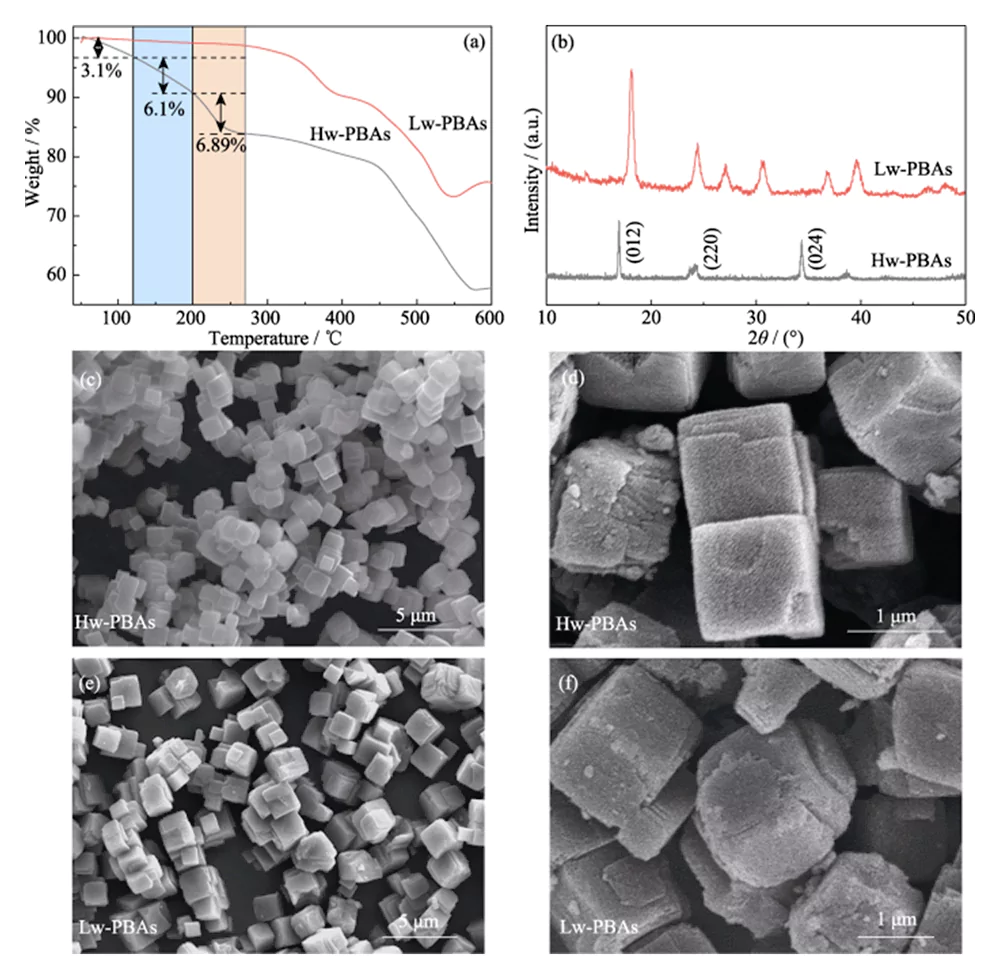
Fig. 1 TGA, analyses de morphologie et de structure de la cathode des PBA
(a) courbes TGA et (b) modèles XRD des Hw-PBA et Lw-PBA ; (c-f) Images SEM de (c, d) Hw-PBA et (e, f) Lw-PBA
La figure 1 (b) montre les spectres XRD des Hw-PBA et Lw-PBA. Les pics de diffraction des Hw-PBA à 2θ = 17,0°, 24,0° et 34,4° correspondent respectivement aux plans cristallins (012), (220) et (024). Après le traitement thermique, le pic de diffraction correspondant au plan cristallin (024) disparaît, indiquant que l'eau cristalline est éliminée avec succès, et les positions des pics de diffraction correspondant aux plans cristallins (012) et (220) se déplacent vers des angles plus élevés, indiquant que le volume unitaire de la cellule diminue après l'élimination de l'eau cristalline. De plus, de nouveaux pics de diffraction apparaissent à 2θ=27,1°, 30,7° et 36,9°, indiquant qu'une structure cristalline trigonale se forme après traitement thermique. L'analyse SEM (Figure 1 (c ~ e)) montre que les Hw-PBA et Lw-PBA ont des morphologies cubiques similaires avec une taille moyenne de 2 à 3 µm. La surface des particules de Lw-PBA obtenues après traitement thermique est légèrement rugueuse (Figure 1 (f)), mais en raison de la faible température de traitement thermique, aucune fusion ni agglomération évidente ne s'est produite. La composition des Lw-PBA a été estimée à Na1,91Fe-[Fe(CN)6]·3,2H2O en analysant la teneur en éléments métalliques par ICP-OES et en mesurant la teneur en eau par TGA.Pour explorer plus en détail la composition chimique et la structure des Hw-PBA et des Lw-PBA, une analyse XPS a été réalisée. Dans le spectre Fe2p XPS haute résolution des Hw-PBA, les deux pics caractéristiques aux énergies de liaison de 708,6 et 721,4 eV correspondent respectivement à Fe (II) et Fe (III) (Figure 2 (a)). Fe (II) et Fe (III) existent également dans les Lw-PBA, mais la proportion de Fe (III) augmente considérablement (Figure 2 (b)). En effet, le [NaH2O]+ est éliminé de la structure des PBA pendant le processus de traitement thermique et le Fe(II) dans les Lw-PBA est partiellement oxydé pour maintenir l'équilibre de valence. Dans le spectre O1s XPS à haute résolution des Hw-PBA, les pics caractéristiques aux énergies de liaison de 536,0, 533,7, 531,9 et 529,7 eV correspondent respectivement à l'eau interstitielle, à l'eau coordonnée, aux groupes hydroxyles de surface et aux espèces d'oxygène dans le réseau des PBA (Figure 2(c)). Après le traitement thermique, le pic caractéristique correspondant à l'eau coordonnée disparaît, indiquant que ce processus peut éliminer efficacement l'eau coordonnée des Lw-PBA (Figure 2 (d)). Au cours de ce processus, le Fe à la surface des PBA réagit avec des groupes hydroxyle pour former des oxydes de fer, provoquant une augmentation considérable du pic caractéristique de Fe-O à l'énergie de liaison de 530,0 eV.
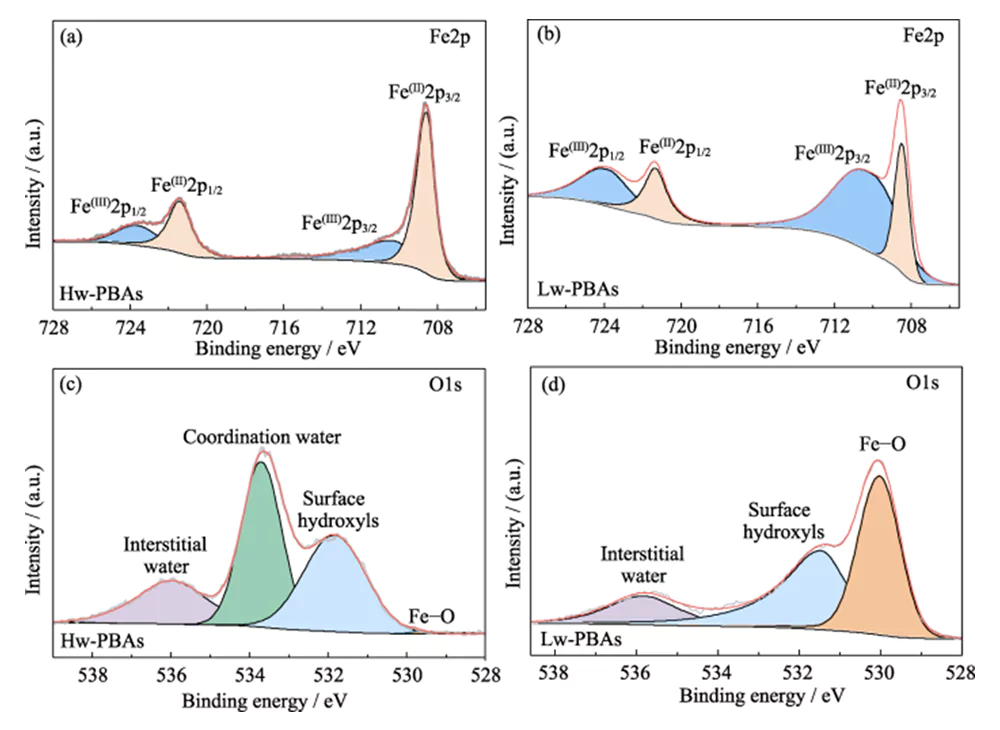
Fig. 2 Composition chimique de la cathode des PBA
(a, b) spectres Fe2p XPS de (a) Hw-PBA et (b) Lw-PBA ; (c, d) Spectres XPS O1s de (c) Hw-PBA et (d) Lw-PBA
2.2 Performances électrochimiques
La figure 3 (a) montre les courbes du cycle de charge-décharge à courant constant de demi-cellules à ions sodium avec des Hw-PBA et des Lw-PBA comme électrodes positives à une densité de courant de 100 mA · g-1, avec une fenêtre de tension de 2,0 ~ 3,8 V (contre Na/Na+). Après 340 cycles de charge-décharge, l'électrode positive Lw-PBA peut toujours maintenir une capacité spécifique élevée de 91 mAh·g-1, avec un taux de rétention de capacité de 88 % et un taux moyen de perte de capacité de charge-décharge unique de seulement 0,035. %, montrant une excellente stabilité de cycle. Dans les mêmes conditions de charge-décharge, le taux de rétention de capacité de l'électrode positive Hw-PBA sans élimination de l'eau cristalline n'est que de 73 %, ce qui montre le rôle important de l'élimination de l'eau cristalline dans l'amélioration de la stabilité du cycle de l'électrode positive du PBA. La figure 3 (b) montre la courbe de charge-décharge à courant constant de la cathode Lw-PBAs à une densité de courant de 100 mA·g-1, montrant une caractéristique typique d'une plate-forme à double tension : (1) La plate-forme de tension d'environ 3,2 V correspond au processus redox de Fe2+/Fe3+ à faible spin (coordonné avec C) ; (2) La plate-forme de tension d'environ 2,9 V correspond au processus rédox du Fe2+/Fe3+ à haut spin (coordonné avec N). L'apparition d'une plate-forme de tension à environ 3,2 V indique que l'élimination de l'eau cristalline est bénéfique pour renforcer la réaction redox du Fe2+/Fe3+ à faible spin dans les PBA, ce qui contribue à améliorer sa capacité de stockage du sodium. Au cours du processus de cycle suivant, la courbe charge-décharge de la cathode Lw-PBA est restée fondamentalement cohérente, montrant une bonne stabilité structurelle. À des densités de courant de 10, 50, 100, 200 et 500 mA·g-1, la cathode Lw-PBA peut maintenir des capacités spécifiques réversibles élevées de 126, 112, 110, 108 et 107 mAh·g-1 (Figure 3 (c)). En particulier, à une densité de courant élevée de 500 mA·g-1, la cathode du Lw-PBA présente une excellente rétention de capacité et sa capacité spécifique est d'environ 13,4 % supérieure à celle du Hw-PBA. Lorsque la densité de courant retombe à 10 mA·g-1, la capacité spécifique de la cathode Lw-PBAs peut être restaurée à 125 mAh·g-1, ce qui est proche de la capacité spécifique initiale, indiquant qu'elle peut maintenir une excellente structure stabilité pendant le stockage rapide du sodium.
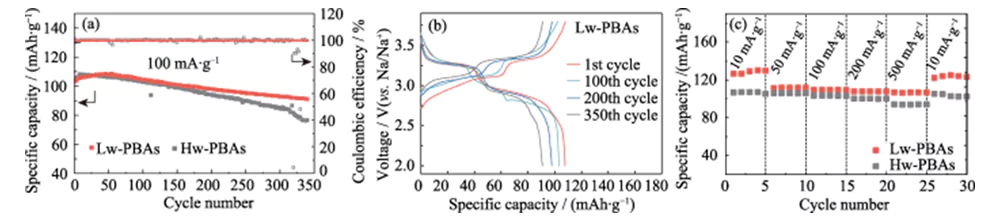
Fig. 3 Performances électrochimiques de la cathode PBA dans une demi-cellule Na-ion
(a) Performances de cyclage des cathodes Lw-PBA et Hw-PBA à une densité de courant de 100 mA·g-1 ; (b) Courbes de charge-décharge de la cathode Lw-PBAs à 100 mA·g-1 ; (c) Capacité de débit des cathodes Lw-PBA et Hw-PBA à diverses densités de courant allant de 10 mA·g-1 à 500 mA·g-1 ; La fenêtre de tension est de 2,0 à 3,8 V (vs Na/Na+) pour tous les tests sur demi-cellule ; Des figurines colorées sont disponibles sur le site
2.3 Analyse in situ du mécanisme de stockage du sodium
L'électrode positive Lw-PBAs a été associée à l'électrode négative HC et une solution DMC/EC contenant 1,0 mol·L-1 NaClO4 et 5,0 % de FEC en masse a été utilisée comme électrolyte liquide (LE) pour assembler une batterie complète (Lw -PBA | LE | HC, Figure 4 (a)). Les changements structurels dynamiques des matériaux des électrodes positives et négatives de la batterie complète au cours des réactions de charge et de décharge ont été étudiés à l'aide d'une technologie d'analyse in situ. L'analyse XRD in situ de l'électrode positive Lw-PBA a montré qu'après avoir augmenté la tension de charge à 3,2 V, les pics de diffraction correspondant à (110) et (104) ont progressivement fusionné pour former un large pic (Figure 4 (b) ). Ce phénomène correspond au processus par lequel Na+ s'échappe de l'électrode positive du Lw-PBAs, provoquant le changement de sa structure cristalline d'une structure trigonale à une structure cubique[21]. Au cours du processus de décharge, aucune nouvelle division de ce large pic en pics de diffraction (110) et (104) n'a été observée, ce qui indique que le processus de changement de phase est irréversible, entraînant la première perte d'efficacité coulombienne. De plus, lors du premier processus de charge et de décharge de l'électrode négative HC, le film d'interphase d'électrolyte solide (SEI) formé à la surface entraîne une perte irréversible de lithium (18 %), ce qui est également l'une des raisons du premier rendement coulombique. perte de la batterie entière (Figure 4 (c, d)).
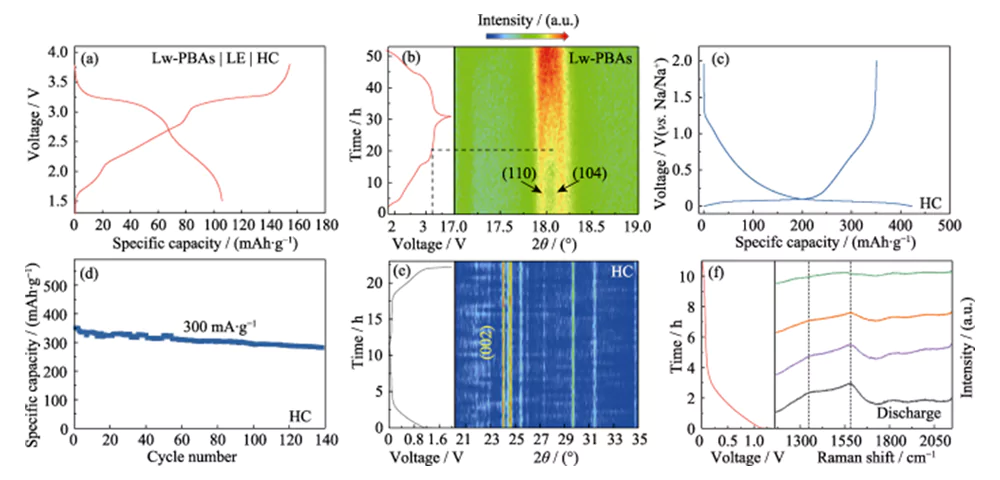
Fig. 4 Analyse in situ du mécanisme de stockage de Na pour la cathode Lw-PBAs et l'anode HC
(a) Courbes de charge-décharge de cellule complète Lw-PBAs|LE|HC ; (b) Modèle XRD in situ de la cathode Lw-PBA pendant le fonctionnement de la cellule complète ; (c) Courbes de charge-décharge pour le premier cycle et (d) stabilité du cycle de l'anode HC à une densité de courant de 300 mA·g-1 ; (e) Modèle XRD in situ et (f) spectres Raman in situ de l'anode HC pendant le fonctionnement de la cellule complète ; Des figurines colorées sont disponibles sur le site
Dans le spectre XRD in situ de l'anode HC, aucun déplacement de pic évident (002) n'a été observé pendant le processus de charge et de décharge, indiquant que Na+ n'a pas été inséré dans les couches de structure graphitées, et aucun pic de diffraction du sodium métallique n'a été observé ( Figure 4(e)). Par conséquent, la capacité de stockage du sodium de l’anode HC peut être due à l’adsorption et au remplissage de Na+ dans les sites de défauts et les pores riches de HC, plutôt qu’à l’intercalation de Na+ ou à la précipitation du sodium métallique (22). Afin d'étudier plus en détail le mécanisme de réaction de stockage du sodium dans HC, une analyse Raman in situ a été réalisée sur l'électrode négative HC pendant le processus de charge et de décharge (Figure 4 (f)). L'électrode négative HC présente des pics caractéristiques Raman évidents à 1 350 et 1 594 cm-1. Le pic caractéristique avec un nombre d'onde de 1350 cm-1 correspond à la vibration d'étirement de la configuration du carbone aromatique (mode G), et le pic caractéristique avec un nombre d'onde de 1594 cm-1 correspond à la structure carbonée défectueuse désordonnée (mode D). Le rapport d'intensité du mode D et du mode G (ID/IG) peut être utilisé pour mesurer le degré de défauts et de désordre des matériaux carbonés. Au cours du processus de décharge, le ID/IG de l'anode HC a diminué avec l'intercalation continue de Na+, indiquant que le comportement d'adsorption significatif de Na+ au niveau de ses sites de défauts est la principale source de capacité de stockage du sodium de l'anode HC.
2.4 Construction et performances d'une cellule complète quasi-solide
Le premier rendement coulombique de la cellule sodium-ion construite à l'aide d'une électrode positive Lw-PBA et d'une électrode négative HC n'est que de 67,3 % (Figure 4 (a)). Pour résoudre ce problème, du Na2C2O4 respectueux de l'environnement, peu toxique et stable à l'air est utilisé comme compensateur de sodium auto-sacrificiel dans l'électrode positive du Lw-PBA afin d'améliorer la première efficacité coulombienne de la cellule complète [23]. La taille des particules du Na2C2O4 commercial est supérieure à des centaines de microns et a une faible activité électrochimique. Par conséquent, il est recristallisé pour obtenir du Na2C2O4 avec une granulométrie de plusieurs microns (Figure 5(a)). Le Na2C2O4 de la taille d'un micron peut libérer une capacité spécifique élevée de 407 mAh·gâ1 pendant le premier processus de charge dans la fenêtre de tension de 2,0 ~ 4,2 V, compensant efficacement la première perte de capacité irréversible de l'électrode positive (Figure 5(b )). La capacité spécifique de décharge initiale de la cellule complète Lw-PBAs|LE|HC avec l'ajout de Na2C2O4 (fraction massique 20 %) peut atteindre 158 mAh·g-1, soit 92,7 % de plus que celle de la cellule complète sans l'ajout. de Na2C2O4 (Figure 5(c)). La cellule complète Lw-PBAs|LE|HC avec l'ajout de Na2C2O4 peut maintenir une capacité spécifique réversible de 110, 101, 92, 87 et 80 mAh·g-1 à des densités de courant de 10, 50, 100, 200 et 500 mA. ·g-1 (Figure 5(d)). À une densité de courant élevée de 500 mA·g-1, après 1 400 cycles stables, la cellule complète Lw-PBAs|LE|HC avec l'ajout de Na2C2O4 peut maintenir une capacité spécifique de 64 mAh·g-1, soit 25,4 % supérieure à celle de la cellule entière sans ajout de Na2C2O4 (Figure 5(e)).
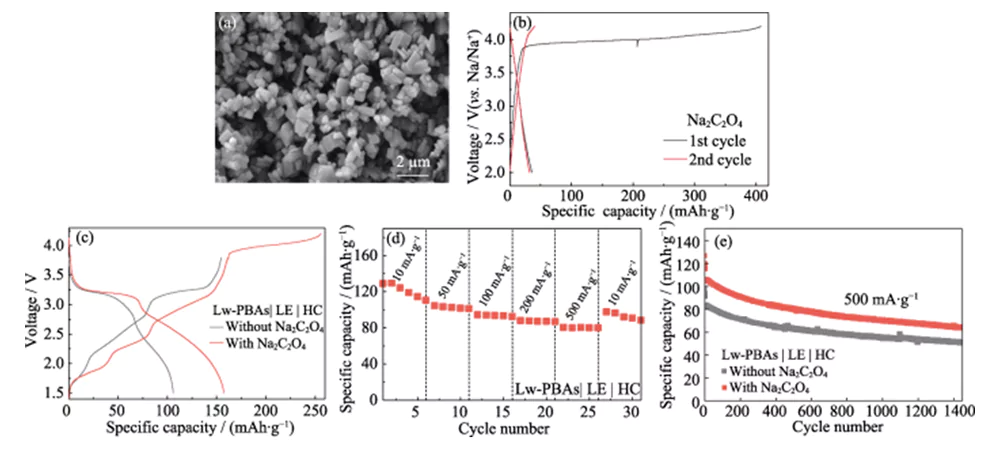
Fig. 5 Effet de Na2C2O4 sur les performances électrochimiques de la cathode Lw-PBAs
(a) image SEM et (b) courbes de charge-décharge de Na2C2O4 avec une taille micrométrique à une densité de courant de 180 mA·g-1 ; (c) Courbes de charge-décharge des cellules complètes Lw-PBAs|LE|HC avec ou sans adoption de Na2C2O4 à une densité de courant de 100 mA·g-1 ; (d) Performances nominales de la cellule complète Lw-PBAs|LE|HC avec Na2C2O4 à diverses densités de courant de 10 à 500 mA·g-1 ; (e) Stabilité du cycle de la cellule complète Lw-PBAs|LE|HC avec ou sans utilisation de Na2C2O4 à une densité de courant élevée de 500 mA·g-1 ; La fenêtre de tension est de 1,5 à 3,8 V pour tous les tests sur cellule complète ; Des figurines colorées sont disponibles sur le site
Sur cette base, le PEGDA a été mélangé avec 1,0 mol·L-1 NaClO4 et un électrolyte DMC/EC avec une fraction massique de 5,0 % de FEC, et l'AIBN a été utilisé comme initiateur de polymérisation thermique pour développer un électrolyte quasi-solide haute performance (GPE ). Par rapport au LE, le GPE présente l’avantage d’être moins sujet aux fuites et d’être peu volatile. Il peut rester stable à une haute tension de 4,9 V (vs Na/Na+) et possède une large fenêtre de stabilité électrochimique (Figure 6(a)). Comparé aux électrolytes solides, le GPE a une conductivité ionique et une compatibilité d'interface plus élevées, et la conductivité ionique à température ambiante est de 3,51 mS·cm-1 (Figure 6(b)). Il a en outre été associé à l'électrode positive Lw-PBAs à faible teneur en eau et à l'électrode négative HC pour construire une batterie complète sodium-ion quasi-solide (Lw-PBAs | GPE | HC). À une densité de courant de 100 mA·g-1, la première capacité spécifique de décharge de la batterie quasi-solide Lw-PBAs|GPE|HC a atteint 147,8 mAh·g-1 (Figure 6(c)). Aux densités de courant de 20, 50, 100, 200 et 500 mA·g-1, les capacités spécifiques peuvent être maintenues à 105, 94, 82, 70 et 58 mAh·g-1 (Figure 6(d)). À une densité de courant de 100 mA·g-1, il peut être cyclé de manière stable plus de 200 fois et l'efficacité coulombienne est proche de 100 % (Figure 6(e)).
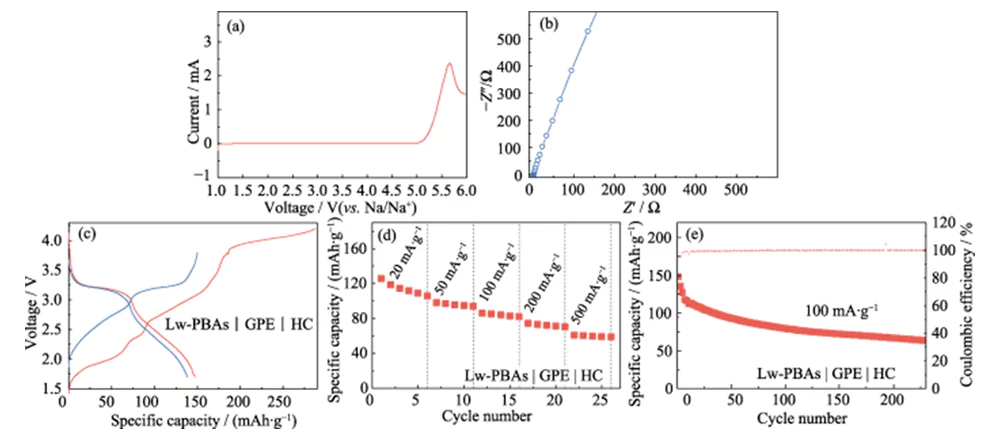
Fig. 6 Performances électrochimiques d'une cellule complète quasi-solide basée sur une cathode Lw-PBAs et un GPE à base de PEGDA
(a) Courbe LSV à une vitesse de balayage de 5 mV·s-1 ; (b) spectre EIS ; (c) Courbes de charge-décharge à une densité de courant de 100 mA·g-1 ; (d) Performances de taux à des densités de courant de 20 à 500 mA·g-1 ; (e) Performance en cyclisme à 100 mA·g-1 ; La fenêtre de tension est de 1,5 à 3,8 V pour tous les tests sur cellule complète
3 Conclusion
Dans cette étude, des matériaux cathodiques PBA à faible teneur en eau ont été préparés par une méthode de traitement thermique simple et efficace. Il a été constaté que l'élimination de l'eau cristalline augmentait non seulement le taux de rétention de capacité de la cathode des PBA de 73 % à 88 % après 340 cycles, mais contribuait également à renforcer la réaction redox du Fe2+/Fe3+ à faible spin dans les PBA, améliorant ainsi sa capacité de stockage du sodium. Le mécanisme dynamique de stockage du sodium de la cathode PBA et de l'anode HC a été révélé par les techniques Raman in situ et XRD in situ. L'analyse a montré que le processus de Na+ s'échappant de la cathode du PBA provoquait un changement irréversible de sa structure cristalline de cubique tridimensionnelle, entraînant la perte du premierL'efficacité coulombienne et l'adsorption de Na+ au niveau de ses sites de défauts étaient la principale source de capacité de stockage du sodium de l'anode HC. Après avoir ajouté un compensateur de sodium Na2C2O4 (fraction massique 20 %) à la cathode, la première capacité de décharge de la cathode PBA a augmenté de 92,7 %. Sur la base de la polymérisation thermique du PEGDA initiée par l'AIBN, un électrolyte quasi-solide haute performance avec une conductivité ionique à température ambiante de 3,51 mS·cm-1 et une fenêtre de stabilité électrochimique élargie à 4,9 V (vs Na/Na+) a été développé. Sur cette base, une cathode PBA à faible teneur en eau avec un compensateur de sodium Na2C2O4 ajouté, une anode HC et un électrolyte solide de référence PEGDA ont été intégrées pour construire une batterie sodium-ion quasi-solide qui peut être cyclée de manière stable plus de 200 fois à une densité de courant de 100 mA·g-1. Des études ont montré qu'une élimination efficace de l'eau cristalline est un moyen nécessaire pour améliorer la stabilité du cycle de la cathode des PBA et réaliser la création de batteries sodium-ion quasi-solides de haute performance.
[1] WANG W L, GANG Y, PENG J et al. Effet de l'élimination de l'eau dans la cathode bleu de Prusse pour les batteries sodium-ion. Av. Fonction. Mater., 2022, 32(25): 2111727.
[2] MENG X Y, LIU Y Z, WANG Z Y, et al. Une pile rechargeable quasi-solide avec une énergie élevée et une sécurité supérieure rendue possible par une chimie redox stable du Li2S dans un électrolyte gel. Énergie Environnement. Sci., 2021, 14(4) : 2278.
[3] CHE H Y, CHEN S L, XIE Y Y, et al. Stratégies de conception d'électrolytes et progrès de la recherche pour les batteries sodium-ion à température ambiante. Énergie Environnement. Sci., 2017, 10(5) : 1075.
[4] LI W K, ZHAO N, BI Z J, et al. Électrolytes céramiques Na3Zr2Si2PO12 pour batterie Na-ion : préparation par méthode de séchage par pulvérisation et ses propriétés. J.Inorg. Mater., 2022, 37(2) : 189.
[5] LI D, LEI C, LAI H et al. Progrès récents dans l’interface entre la cathode et l’électrolyte solide grenat pour toutes les batteries Li-ion à semi-conducteurs. J.Inorg. Mater., 2019, 34(7): 694.
[6] KIM KJ, BALAISH M, WADAGUCHI M et al. Batteries Li-Métal Solides : enjeux et horizons des électrolytes solides oxydes et sulfurés et de leurs interfaces. Av. Energy Mater., 2021, 11(1) : 2002689.
[7] GAO H, GUO B, SONG J et al. Un électrolyte composite gel-polymère/fibre de verre pour batteries sodium-ion. Av. Energy Mater., 2015, 5(9) : 1402235.
[8] LIU Y Z, MENG X Y, SHI Y, et al. Batteries à semi-conducteurs longue durée sans anode, rendues possibles par l'ingénierie d'interface couplée à compensation Li. Av. Mater., 2023, 35(42): e2305386.
[9] DU G Y, TAO M L, LI J, et al. Batterie sodium-ion solide à basse température de fonctionnement, à débit élevé et durable, à base d'électrolyte polymère et de cathode bleu de Prusse. Av. Energy Mater., 2020, 10(5) : 1903351.
[10] PENG J, ZHANG W, LIU QN, et al. Analogues du bleu de Prusse pour les batteries sodium-ion : passé, présent et futur. Av. Mater., 2022, 34(15): 2108384.
[11] LU Y H, WANG L, CHENG J G, et al. Bleu de Prusse : un nouveau cadre de matériaux d'électrodes pour batteries au sodium. Chimique. Commun., 2012, 48(52): 6544.
[12] SÃNGELAND C, MOGENSEN R, BRANDELL D, et al. Cyclage stable des batteries tout solide au sodium métal avec des électrolytes polymères à base de polycarbonate. Application ACS. Poly. Mater., 2019, 1(4): 825.
[13] KIM T, AHN SH, SONG Y Y, et al. Électrolytes solides conducteurs sodium-ion de type bleu de Prusse pour toutes les batteries à semi-conducteurs. Angew. Chimique. Int. Éd., 2023, 62(42) : e202309852.
[14] SONG J, WANG L, LU Y H, et al. Élimination du H2O interstitiel dans les hexacyanométallates pour une cathode supérieure d'une batterie sodium-ion. Confiture. Chimique. Soc., 2015, 137(7) : 2658.
[15] LIU Y, FAN S, GAO Y, et al. Synthèse isostructurale d'analogues du bleu de Prusse à base de fer pour batteries sodium-ion. Petit, 2023, 19(43) : e2302687.
[16] WANG W, GANG Y, HU Z, et al. Évolution structurelle réversible du bleu de Prusse rhomboédrique riche en sodium pour les batteries sodium-ion. Nat. Commun., 2020, 11 : 980.
[17] YOU Y, YU X Q, YIN Y X, et al. Hexacyanoferrate de fer et de sodium à haute teneur en Na comme matériau cathodique riche en Na pour les batteries Na-ion. Nano Res., 2014, 8(1) : 117.
[18] REN W H, QIN M S, ZHU Z X, et al. Activation des sites de stockage du sodium dans les analogues du bleu de Prusse via gravure de surface. Nano Lett., 2017, 17(8) : 4713.
[19] ZHANG H, GAO Y, PENG J, et al. Analogues bleu de Prusse avec une orientation optimisée du plan cristallin et de faibles défauts cristallins vers des batteries alcalines-ion de 450 Wh·kgâ1. Angew. Chimique. Int. Éd., 2023, 62(27) : e202303953.
[20] ZHANG Z H, AVDEEV M, CHEN H C, et al. Analogues du bleu de Prusse lithiés comme matériaux actifs d'électrode positive pour batteries lithium-ion non aqueuses stables. Nat. Commun., 2022, 13 : 7790.
[21] JIANG M, HOU Z, MA H, et al. Résoudre la désactivation des sites Fe à faible spin en redistribuant la densité électronique vers le stockage du sodium à haute énergie. Nano Lett., 2023, 23(22) : 10423.
[22] TANG Z, ZHANG R, WANG H Y, et al. Révéler la formation de pores fermés de déchets de carbone dur dérivés du bois pour une batterie sodium-ion avancée. Nat. Commun., 2023, 14 : 6024.
[23] NIU YB, GUO YJ, YIN YX, et al. Compensation cathodique sodium à haut rendement pour batteries sodium-ion. Av. Mater., 2020, 32(33): e2001419.





