Pourquoi les batteries entièrement solides sont-elles une tendance du secteur ?
Haute sécurité :
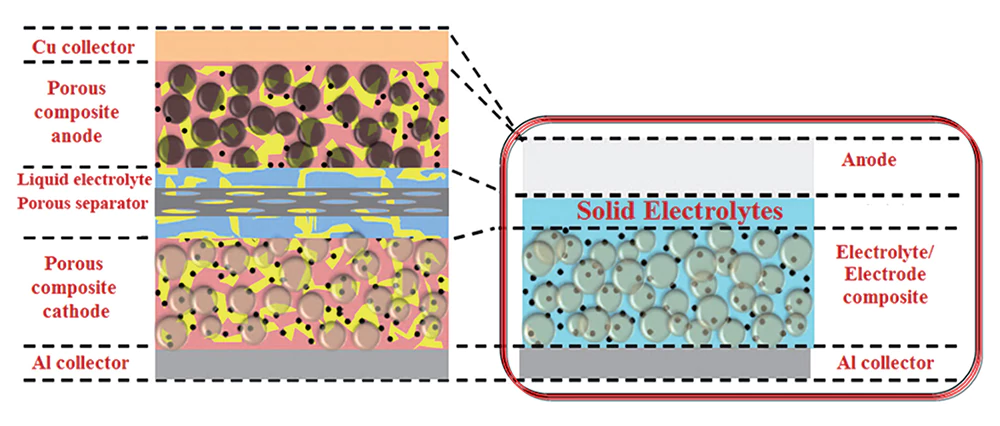
Les problèmes de sécurité des batteries liquides ont toujours été critiqués. L'électrolyte est facilement inflammable à haute température ou sous un impact violent. Sous un courant élevé, les dendrites de lithium sembleront également percer le séparateur et provoquer un court-circuit. Parfois, l'électrolyte peut subir des réactions secondaires ou se décomposer à haute température. La stabilité thermique des électrolytes liquides ne peut être maintenue que jusqu'à 100 °C, tandis que les électrolytes solides oxydés peuvent atteindre 800 °C, et les sulfures et halogénures peuvent également atteindre 400 °C. Les oxydes solides sont plus stables que les liquides et, en raison de leur forme solide, leur résistance aux chocs est bien supérieure à celle des liquides. Par conséquent, les batteries à semi-conducteurs peuvent répondre aux besoins de sécurité des personnes.
Haute densité énergétiqueï¼
À l’heure actuelle, les batteries à semi-conducteurs n’ont pas atteint une densité énergétique supérieure à celle des batteries liquides, mais en théorie, les batteries à semi-conducteurs peuvent atteindre une densité énergétique très élevée. Les batteries à semi-conducteurs n’ont pas besoin d’être enveloppées dans un liquide pour éviter les fuites comme les batteries liquides. Par conséquent, les coques, films d'emballage, matériaux de dissipation thermique, etc. redondants peuvent être éliminés et la densité énergétique peut être considérablement améliorée.
Haute puissance :
Les ions lithium dans les batteries liquides sont transportés par conduction, tandis que les ions lithium dans les batteries à semi-conducteurs le sont par conduction par saut, ce qui est plus rapide et a un taux de charge et de décharge plus élevé. La charge rapide a toujours été une difficulté dans la technologie des batteries liquides, car le lithium sera précipité si la vitesse de charge est trop rapide, mais ce problème n'existe pas dans les batteries entièrement solides.
Performances à basse température :
Les batteries liquides fonctionnent généralement de manière stable entre -10°C et 45°C, mais leur autonomie diminue considérablement en hiver. La température de fonctionnement des électrolytes solides est comprise entre -30 °C et 100 °C. Il n'y aura donc aucune réduction de la durée de vie de la batterie, sauf dans les zones extrêmement froides, et aucun système de gestion thermique complexe n'est requis.
Longue durée de vie :
Parmi les batteries liquides, la durée de vie moyenne des batteries ternaires est de 500 à 1 000 cycles, et la durée de vie du lithium fer phosphate peut atteindre 2 000 cycles. Le film mince entièrement solide peut atteindre 45 000 cycles dans le futur et la durée de vie du 5C en laboratoire peut atteindre 10 000 fois. Lorsque le coût de production d’une même densité énergétique peut converger, la rentabilité des batteries à semi-conducteurs est sans précédent.
Comparaison de 4 électrolytes inorganiques solides
Les types de matériaux des électrolytes solides peuvent être divisés en quatre catégories : oxydes, sulfures, polymères et halogénures. Chacun de ces quatre types d'électrolytes possède des propriétés physiques et chimiques différentes, qui déterminent la difficulté de la R&D, de la production et de l'industrialisation ainsi que sa position future sur le marché.
Électrolytes d'oxyde :
Avantages : La conductivité ionique est au milieu et elle présente la meilleure stabilité électrochimique, mécanique et thermique. Il peut être adapté aux matériaux cathodiques haute tension et aux anodes métalliques au lithium. Excellente conductivité électronique et sélectivité ionique. Dans le même temps, le degré de continuité des équipements et le coût de fabrication présentent également de grands avantages. La capacité globale est la plus complète.
Inconvénients : la stabilité de la réduction est légèrement faible, cassante et peut provoquer des fissures.
Les électrolytes d'oxyde ont une résistance mécanique élevée, une bonne stabilité thermique et atmosphérique et de larges fenêtres électrochimiques. Les électrolytes oxydes peuvent être divisés en états cristallins et amorphes. Les électrolytes d'oxyde cristallin courants comprennent le type pérovskite, le type LISICON, le type NASICON et le type grenat. Les électrolytes d'oxyde peuvent résister à des tensions élevées, avoir des températures de décomposition élevées et avoir une bonne résistance mécanique. Cependant, sa conductivité ionique à température ambiante est faible (<10-4 S/cm), son contact avec l'interface solide-solide des électrodes positives et négatives est médiocre et il est généralement épais (200μm), ce qui réduit considérablement la densité énergétique volumique de la batterie. Grâce au dopage des éléments et à la modification des joints de grains, la conductivité à température ambiante des électrolytes d'oxyde peut être augmentée jusqu'à l'ordre de 10-3 S/cm. Le contrôle du volume cristallin et l’ajout de revêtements polymères peuvent améliorer le contact interfacial entre l’électrolyte oxyde et les électrodes positives et négatives. Des membranes électrolytiques solides ultrafines peuvent être produites par des méthodes de revêtement en solution/boue.Électrolyte sulfure :
Avantages : conductivité ionique la plus élevée, petite résistance aux joints de grains, bonne ductilité et bonne sélectivité ionique.
Inconvénients : mauvaise stabilité chimique, réagit avec le lithium métallique et réagit facilement avec l'air humide. Le coût est plus élevé et les propriétés mécaniques sont médiocres. À l’heure actuelle, la production doit encore être réalisée dans une boîte à gants, ce qui rend difficile la production en masse à grande échelle.
Les électrolytes sulfurés ont une conductivité élevée à température ambiante et une bonne ductilité, et leur stabilité peut être améliorée par dopage et revêtement. Les électrolytes sulfurés se présentent actuellement sous trois formes principales : le verre, la vitrocéramique et les cristaux. Les électrolytes sulfurés ont une conductivité élevée à température ambiante, qui peut être proche de celle des électrolytes liquides (10-4-10-2 S/cm), une dureté modérée, un bon contact physique d'interface et de bonnes propriétés mécaniques. Ce sont des matériaux candidats importants pour les batteries à semi-conducteurs. Cependant, les électrolytes sulfurés ont une fenêtre électrochimique étroite, une mauvaise stabilité d’interface avec les électrodes positives et négatives et sont très sensibles à l’humidité. Il peut réagir avec des traces d’eau dans l’air et libérer du sulfure d’hydrogène gazeux toxique. La production, le transport et la transformation ont des exigences environnementales très élevées. Les méthodes de modification telles que le dopage et le revêtement peuvent stabiliser l'interface entre le sulfure et les électrodes positives et négatives, les rendant adaptées à divers types de matériaux d'électrodes positives et négatives, et même utilisées dans les batteries lithium-soufre.
La préparation de batteries à électrolyte sulfuré répond à des exigences environnementales élevées. Les électrolytes sulfurés ont une conductivité élevée et sont relativement mous et peuvent être produits par des méthodes de revêtement. Le processus de production n'est pas très différent du processus de production de batterie liquide existant, mais afin d'améliorer le contact d'interface de la batterie, il est généralement nécessaire d'effectuer plusieurs pressages à chaud après le revêtement et d'ajouter une couche tampon pour améliorer le contact d'interface. Les électrolytes sulfurés sont très sensibles à l'humidité et peuvent réagir avec des traces d'eau dans l'air pour générer du sulfure d'hydrogène, un gaz toxique. Les exigences environnementales pour la fabrication de batteries sont donc très élevées.
Électrolyte polymère :
Avantages : bonne sécurité, bonne flexibilité et contact d'interface, film facile à former.
Inconvénients : La conductivité ionique est très faible à température ambiante et la stabilité thermique est médiocre.Électrolyte halogénure :
Avantages : faible résistance électronique, sélectivité ionique élevée, stabilité de réduction élevée et pas facile à craquer.
Inconvénients : il est encore au stade de laboratoire, a une mauvaise stabilité chimique et une faible stabilité à l'oxydation, et a une résistance ionique élevée.
En raison des avantages et des inconvénients importants des halogénures et des polymères, la future concurrence mondiale pour les batteries à semi-conducteurs se concentrera principalement sur les oxydes et les sulfures. En fait, en raison de sa faible stabilité chimique, les types de matériaux pouvant être sélectionnés pour les électrolytes sulfurés sont très restreints, mais tant que des matériaux appropriés et des avancées technologiques sont trouvés, cette lacune peut être comblée.
Cependant, du point de vue de l’industrialisation, des processus complexes entraîneront des coûts plus élevés et un plafond d’échelle, de sorte que les électrolytes solides à base d’oxydes sont actuellement la norme dans le développement de batteries à semi-conducteurs. Des batteries liquides aux batteries à semi-conducteurs, il y aura une étape de batterie semi-solide, et la plus appropriée à ce stade est la voie oxyde. C'est en raison de ses performances globales et de ses avantages en termes de coûts. Les batteries semi-solides peuvent remplacer plus rapidement les batteries liquides actuelles, profitant progressivement des avantages et de la rentabilité des batteries à semi-conducteurs.
Cependant, avec les progrès technologiques, il est encore difficile de savoir si le monde sera dominé par les oxydes ou les sulfures à l’avenir. Le cœur de la technologie des batteries à semi-conducteurs est la recherche et le développement d’électrolytes à semi-conducteurs. Bien que les matériaux électrolytiques solides actuels aient fait de grands progrès, ils présentent encore des problèmes tels qu'une mauvaise conductivité, une grande résistance d'interface et des coûts de préparation élevés. Des recherches fondamentales continues et des percées technologiques sont nécessaires pour améliorer la conductivité et la stabilité des électrolytes solides.